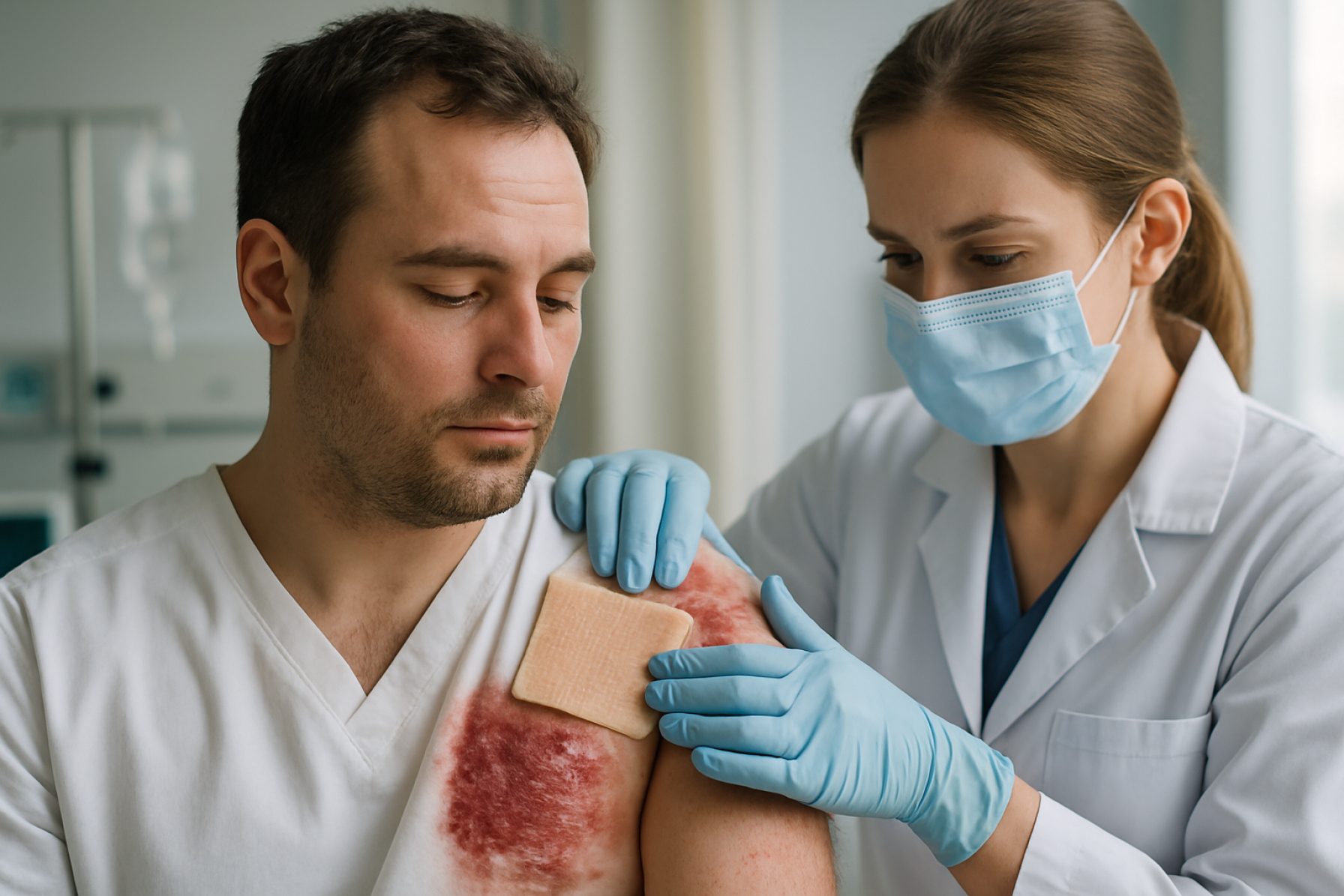
Tehnologije xeno presaditve kože leta 2025: Pioneering a New Era for Severe Burn Treatment and Tissue Engineering. Raziskujte inovacije, tržne sile in regulativne premike, ki oblikujejo naslednjih pet let.
- Izvršni povzetek: Stanje xeno presaditve kože leta 2025
- Velikost trga, napovedi rasti in ključni motivi (2025–2030)
- Tehnološke inovacije: Od genetsko spremenjenih prašičev do bioinženirskih presadkov
- Vodilna podjetja in raziskovalne ustanove: Profiles in Strategic Initiatives
- Klinična preskušanja in aplikacije v realnem svetu: Napredek in rezultati
- Regulativno okolje: Odobritve, smernice in globalne variacije
- Etične, varnostne in imunološke razmere v xeno presaditvi
- Izvori, proizvodnja in izzivi skalabilnosti
- Konkurenčno okolje: Alografti, avtografti in sintetične alternative
- Prihodnji obeti: Zasebni trendi, investicijski vroči kraji in dolgoročni vpliv
- Viri in reference
Izvršni povzetek: Stanje xeno presaditve kože leta 2025
Xeno presaditev kože — presaditev kože iz nečloveških vrst na ljudi — je v zadnjih letih napredovala hitro, motivirana z nujnimi kliničnimi potrebami in preboji v genetskem inženirstvu. Leta 2025 se področje preusmeri iz eksperimentalnih in usmiljenjskih primerov v zgodnje klinične oblike, zlasti za žrtve hudih opeklin in paciente z obsežnimi izgubami kože, kjer človeški darovani presadki niso zadostni ali na voljo.
Največji napredek je bil dosežen z genetsko spremenjeno kožo prašičev, ki ponuja skalabilno in imunološko združljivo alternativo človeškim alograftom. Podjetja, kot sta Revivicor in eGenesis, so v ospredju, saj izkoriščajo napredne tehnologije urejanja genov, da odstranijo ključne prašičje antigene, ki sprožijo zavrnitev pri ljudeh. V letih 2023 in 2024 sta obe podjetji poročali o uspešnih predkliničnih poskusih, ki so pokazali zmanjšano hiperakutno zavrnitev in izboljšano preživetje presadkov v modelih nečloveških primatov. Ti rezultati so odprli pot prvotnim kliničnim preskušanjem pri ljudeh, ki naj bi se razširila leta 2025 in kasneje.
Hkrati podjetje Universal Skin in druge nove biotehnične firme razvijajo linije kože prašičev “univerzalnega darovalca”, kar dodatno zmanjšuje imunogenost in tveganje prenosa zoonotskih bolezni. Ti napori so podprti z rigoroznim presejanjem in protokoli inaktivacije patogenov, v skladu z razvijajočimi se regulativnimi smernicami agencij, kot sta FDA in EMA.
Klinični obeti za xeno presaditev kože leta 2025 so previdno optimistični. Zgodnje usmiljeni primeri v Združenih državah in Evropi so pokazali, da lahko genetsko inženirana koža prašičev zagotovi začasno zaščito ran, spodbudi celjenje in zmanjša tveganje okužb, pri čemer so režimi imunosupresije obvladljivi. Vendar pa dolgotrajna presaditev in popolna imunološka sprejemljivost ostajajo izzivi, in večina aplikacij je trenutno omejena na začasno zaščito in ne na trajno presaditev.
V prihodnjih letih pričakujemo:
- Širitev kliničnih preskušanj za genetsko spremenjeno kožo prašičev v glavnih centrih za opekline po vsem svetu.
- Dodatno izpopolnjevanje tehnik urejanja genov za izboljšanje preživetja in varnosti presadkov.
- Povečano sodelovanje med biotehnološkimi podjetji, akademskimi centri in regulativnimi organi za vzpostavitev standardiziranih protokolov in meril varnosti.
- Poteza komercialnega lansiranja prvih odobrenih xeno presadkov kože za klinično uporabo, odvisno od izidov preskušenj in regulativnega pregleda.
Na kratko, leto 2025 predstavlja prelomno leto za tehnologije xeno presaditve kože, s vodilnimi podjetji, kot sta Revivicor in eGenesis, ki vodijo prehod iz laboratorijskih inovacij v klinične rešitve v resničnem svetu. Prihajajoča leta bodo ključna za določitev skalabilnosti, varnosti in sprejemljivosti teh transformativnih terapij.
Velikost trga, napovedi rasti in ključni motivi (2025–2030)
Globalni trg za tehnologije xeno presaditve kože je pripravljen na pomembno rast med letoma 2025 in 2030, kar motivira napredovanje v genetskem inženirstvu, naraščajoča incidenca hudih opek in kroničnih ran ter trajna pomanjkljivost človeške darovane kože. Leta 2025 sektor ostaja v predkomercialni ali zgodnji komercialni fazi, s številnimi podjetji in raziskovalnimi konzorciji, ki napredujejo z genetsko spremenjenimi presadki kože prašičev proti klinični uporabi.
Ključni igralci v tem prostoru vključujejo Revivicor, podružnico United Therapeutics, ki je pionir pri razvoju genetsko inženiranih prašičev za presaditev organov in tkiv. Njihovi prašiči GalSafe™, zasnovani za odpravo alergij na alfa-gal, ki je odgovoren za hiperakutno zavrnitev, so dobili odobritev FDA za prehrano in medicinsko uporabo, kar postavlja temelje za klinične xeno presadke. United Therapeutics še naprej investira v povečanje proizvodnje in izpopolnjevanje imunološke združljivosti za aplikacije kože.
Drugo pomembno podjetje je Xenothera, ki razvija imunomodulatorne rešitve in ima trenutna raziskovanja na področju xeno presaditve, vključno s kožo. Poleg tega eGenesis izkorišča urejanje genov CRISPR za ustvarjanje prašičjih tkiv z več genetskimi modifikacijami za zmanjšanje tveganja zavrnitve in prenosa patogenov, s kožnimi presadki kot potencialno aplikacijo.
Rast trga je podprta z naraščajočo svetovno obremenitvijo s poškodbami od opek—ocenjuje se na 11 milijonov ljudi letno po vsem svetu—ter naraščajočo prevalenco kroničnih ran, zlasti med starujočimi populacijami in tistimi z diabetesom. Omejena dostopnost alogeničnih (človeških) presadkov kože, zlasti v situacijah množičnih posledic ali vojaških okoljih, dodatno pospešuje povpraševanje po alternativnih rešitvah, kot so xeno presadki.
Od leta 2025 naprej se pričakuje, da bo trg prešel iz eksperimentalnih in usmiljeniških primerov v zgodnjo komercialno sprejetje, zlasti v regijah z naprednimi regulativnimi okviri in uveljavljenimi bioproizvodnimi zmožnostmi. Napredni pristop FDA do xeno presaditve, kot ga potrjujejo nedavne odobritve, bo verjetno pospešil podobne regulativne poti v Evropi in Azijsko-pacifiški regiji.
Ključni motivi rasti za obdobje 2025–2030 vključujejo:
- Napredovanje v urejanju genov in presejanju patogenov, ki izboljšujeta varnost in združljivost presadkov.
- Strateška partnerstva med biotehnološkimi podjetji, akademskimi centri in zdravstvenimi ponudniki za pospešitev kliničnih preskušanj in komercializacije.
- Interes vlade in obrambnega sektorja za zaloge xeno presadka kože za pripravljenost v nujnih primerih.
- Naraščajoče naložbe v infrastrukturo bioproizvodnje, ki omogoča skalabilno proizvodnjo klinično primernih prašičjih kož.
Čeprav trg ostaja novinec leta 2025, napovedi kažejo na obetavno rast, saj se klinična učinkovitost in varnost dokazujeta, regulativne odobritve širijo, in proizvodni kapaciteti se povečujejo. Naslednjih pet let bo verjetno videlo prve komercialne xeno presadke kože, ki bodo prišli v izbrane bolnišnice, širša sprejemljivost pa se pričakuje, ko se bodo klinične in ekonomske koristi validirale.
Tehnološke inovacije: Od genetsko spremenjenih prašičev do bioinženirskih presadkov
Xeno presaditev kože — presaditev kože iz nečloveških vrst, predvsem genetsko spremenjenih prašičev, na ljudi — je dosegla pomemben tehnološki napredek do leta 2025, motiviran z nujnimi kliničnimi potrebami, kot so hude opekline in kronične rane. Področje se hitro razvija s poudarkom na genetsko spremenjenih prašičih in bioinženirskih presadkih, katerih cilj je premagati imunološke ovire in izboljšati preživetje presadkov.
Genetsko spremenjeni prašiči so postali glavni vir za xeno, saj je njihova fiziološka podobnost človeškim zelo uporabna in omogoča veliko vzrejo. Podjetja, kot sta Revivicor in EGEBiotech, so v ospredju, inženiring tem prašiče z več genetskimi popravki za zmanjšanje izraza antigenov, odgovornih za hiperakutno zavrnitev. Te modifikacije pogosto vključujejo izkoriščanje genov, ki kodirajo alfa-gal in druge xenoantigene, ter vstavljanje humantih regulativnih proteinov za komplement, da dodatno zmanjšamo imunološki odziv.
V letih 2023 in 2024 so predklinične študije pokazale, da so kožni presadki iz teh genetsko spremenjenih prašičev lahko preživeli več tednov na nečloveških primatih brez takojšnje zavrnitve, kar predstavlja pomembno izboljšanje v primerjavi s prejšnjimi poskusi. Pričakuje se, da bodo klinična preskušanja v začetni fazi izvedena leta 2025, regulativne agencije pa natančno nadzorujejo varnost in učinkovitost. Ameriška agencija za hrano in zdravila (FDA) je zagotovila smernice za protokole xeno presaditev, podjetja pa si prizadevajo izpolniti te stroge zahteve.
Parallel to advances in genetic engineering, bioengineered skin grafts are gaining traction. Te grafts combine porcine-derived extracellular matrices with human cells or synthetic scaffolds to create hybrid constructs that promote integration and healing. Organogenesis and AVITA Medical are notable players developing such products, leveraging their expertise in regenerative medicine and wound care. Their technologies aim to provide temporary or permanent coverage for extensive wounds, reducing infection risk and improving patient outcomes.
Looking ahead, the next few years are expected to see the first-in-human trials of multi-gene-edited pig skin grafts, with a focus on safety, immunogenicity, and functional integration. Advances in gene editing tools, such as CRISPR/Cas9, are likely to accelerate the development of even more compatible donor animals. Additionally, the integration of 3D bioprinting and tissue engineering may enable the customization of grafts to match patient-specific needs, further enhancing the clinical utility of xenotransplantation technologies.
Overall, the convergence of genetic engineering, tissue engineering, and regulatory progress positions skin xenotransplantation as a promising solution for critical unmet medical needs, with 2025 poised to be a pivotal year for clinical translation and commercialization.
Vodilna podjetja in raziskovalne ustanove: Profiles in Strategic Initiatives
Xeno presaditev kože — uporaba kože, izvorne iz živali, za zdravljenje ran pri ljudeh — je napredovala hitro, s številnimi podjetji in raziskovalnimi ustanovami na čelu prehoda predkliničnih prebojev v klinične in komercialne resničnosti. Leta 2025 je sektor obarvan s kombinacijo uveljavljenih biotehnoloških podjetij, inovativnih zagonskih podjetij in akademskih sodelovanj, ki vse usmerjajo svoj naboj na obvladovanje globalne pomanjkljivosti človeške darovane kože za hude opekline in kronične rane.
Globalni vodja v xeno presaditvi, Revivicor (podružnica United Therapeutics Corporation), je izkoristil svoje znanje na področju genetskega inženirstva prašičev za razvoj prašičjih tkiv z zmanjšano imunogenostjo. Medtem ko je Revivicor najbolj znan po svojem delu v solidnih organih xeno presaditve, so njihovi prašiči GalSafe — zasnovani za odpravo sladkorja alfa-gal, odgovornega za hiperakutno zavrnitev — prav tako v raziskavah kot vir za kožne presadke. Potekajoče sodelovanje podjetja z akademskimi zdravstvenimi centri naj bi prineslo klinične podatke o varnosti in učinkovitosti prašičjih presadkov v naslednjih nekaj letih.
Drugi pomemben igralec, Genopole, Francija, vodilni biokluster za genetsko in biotehnološko inovacijo, podpira številna zagonska podjetja in raziskovalne skupine, osredotočene na xeno presaditev. S svojim inkubatorjem in programi financiranja Genopole spodbuja razvoj genetsko spremenjenih živalskih modelov in naprednih platform tkivnega inženiringa, s posebnim poudarkom na imunomodulaciji in nadzoru okužb za kožne presadke.
V Aziji je podjetje Sinogene Biotechnology razširilo svoj portfelj od kloniranja živali do razvoja genetsko inženiranih prašičev za biomedicinske aplikacije, vključno s kožnimi xeno presadki. Raziskovalni oddelek podjetja aktivno sodeluje s kitajskimi bolnišnicami pri začetku kliničnih preskušanj prašičje kože za bolnike z opeklinami, pri čemer pričakujejo regulativne predloge do leta 2026.
Akademske institucije ostajajo ključne pri napredku na tem področju. Transplantacijski center Massachusetts General Hospital (MGH), v sodelovanju z biotehnološkimi podjetji, izvaja predklinične študije o imunoprofilaktičnih režimih in genetsko spremenjeni prašičji koži. MGH-ova raziskava naj bi usmerila zasnovo kliničnih poskusov pri ljudeh v ZDA, ki bi se lahko začeli v naslednjih dveh do treh letih.
V prihodnosti se pričakuje, da bodo strateške iniciative teh organizacij zgoščene na izpopolnjevanje genetskih modifikacij za minimizacijo zavrnitve, širitev reje zdravih živali in navigacijo kompleksnih regulativnih okvirov. Naslednjih nekaj let bo najverjetneje videlo prva nadzorovana klinična preskušanja genetsko spremenjene prašičje kože, z možnostjo, da spremenijo oskrbo bolnikov z opeklinami in obvladovanje ran po vsem svetu.
Klinična preskušanja in aplikacije v realnem svetu: Napredek in rezultati
Xeno presaditev kože — presaditev kože iz nečloveških vrst, predvsem genetsko spremenjenih prašičev, na ljudi — je v zadnjih letih hitro napredovala, leto 2025 pa predstavlja prelomno obdobje za klinični prenos in aplikacijo v realnem svetu. Tehnologija se ukvarja s kritičnimi pomanjkljivostmi autolognih in alogeničnih kožnih presadkov za žrtve hudih opeklin in paciente z obsežnimi izgubami kože, ponujajoč potencialno rešitev tam, kjer človeška darovana koža ni na voljo.
V letih 2024 in 2025 so bila izvedena ali so v teku številna klinična preskušanja zgodnjih faz, ki se osredotočajo na varnost, imunogenost in učinkovitost kožnih presadkov iz prašičev. Zanimivo je, da je Xenothera, francosko biotehnološko podjetje, na čelu tega podviga z izkoriščanjem svojega znanja na področju imunomodulacije in genetskega inženirstva za razvoj prašičjih kožnih presadkov z zmanjšano imunogenostjo. Njihove predklinične študije so pokazale obetavne rezultate pri minimizaciji akutne zavrnitve, v letu 2025 pa se pričakuje, da bo podjetje objavilo začasne podatke iz svojih kliničnih preskušanj pri ljudeh.
Drug ključni akter, Revivicor (podružnica United Therapeutics), je razvil multi-gene-edited prašiče, katerih tkiva naj bi bila bolj združljiva z človeškim imunskim sistemom. Leta 2024 je prašičev kožni graft Revivicor vstopil v protokole usmiljenjskega zdravljenja v izbranih ameriških centrih za opekline, pri čemer so prvotni izidi pokazali izboljšano preživetje presadkov in zmanjšano potrebo po imunoprofilaktiki v primerjavi s prejšnjimi generacijami xeno presadkov. Podjetje sodeluje z akademskimi zdravstvenimi centri, da bi leta 2025 zagnalo formalna preskušanja faze I/II, ki se osredotočajo na tako akutno oskrbo opeklin kot na upravljanje kroničnih ran.
V Aziji je Sinogene, kitajsko biotehnološko podjetje, specializirano za genetsko inženirstvo živali, napovedalo razvoj genetsko spremenjenih prašičev za xeno presaditev kože. Leta 2025 naj bi Sinogene začelo pilota kliničnih študij v sodelovanju z glavnimi kitajskimi bolnišnicami, s ciljem obravnave visoke incidence hudih opeklin v regiji.
Aplikacije v realnem svetu ostajajo omejene na strogo regulirane klinične nastavitve, s strogim nadzorom nacionalnih zdravstvenih organov. Zgodnji podatki iz programov usmiljenega zdravljenja in razširjenega dostopa kažejo, da genetsko spremenjeni prašičji kožni presadki zagotavljajo učinkovito začasno pokritje ran, zmanjšujejo stopnje okužb in olajšujejo celjenje, dokler ni mogoče izvesti autolognih presaditev. Vendar pa dolgoročne posledice, vključno z kronično zavrnitvijo in zoonotskim tveganjem, ostajajo predmet podrobnega proučevanja.
V prihodnosti se pričakuje, da se bodo klinična preskušanja širila, izpopolnjevale se bodo genetske modifikacije za dodatno zmanjšanje imunogenosti in razvijali se bodo standardizirani protokoli za aplikacijo xeno presadkov. Regulativne agencije v ZDA, Evropi in Aziji pozorno spremljajo te napredke, z možnostjo, da bi dobili pogojne odobritve, če bodo tekoča preskušanja še naprej dokazovala varnost in učinkovitost. Področje je pripravljeno na pomembne preboje, z obetom, da bo globalno spremenilo oskrbo z opeklinami in ranami.
Regulativno okolje: Odobritve, smernice in globalne variacije
Regulativno okolje za tehnologije xeno presaditve kože se hitro razvija, saj znanstveni napredki te izdelke približujejo klinični uporabi. Leta 2025 regulativne agencije po vsem svetu aktivno razvijajo in izpopolnjujejo okvire, da se spopadejo z edinstvenimi izzivi, ki jih predstavljajo xeno presadki kože, še posebej tisti, ki izhajajo iz genetsko spremenjenih prašičev. Ti izzivi vključujejo pomisleke glede prenosa zoonotskih bolezni, imunološke združljivosti, etičnih vprašanj in dolgoročnega nadzora varnosti.
V Združenih državah je Ameriška agencija za hrano in zdravila (FDA) vzpostavila smernice za proizvode xeno presaditve, ki zahtevajo stroge predklinične in klinične podatke za dokazovanje varnosti in učinkovitosti. FDA Center za oceno biologij in raziskave (CBER) nadzoruje regulativno pot za te proizvode ter poudarja potrebo po celovitih ocenah tveganja, vključno s potencialom prenosa prašičjih endogenih retrovirusov (PERV). V zadnjih letih je FDA odobrila raziskovalna nova zdravila (IND) za zgodnja klinična preskušanja genetsko inženiranih prašičjih kožnih presadkov, kar odraža previden, vendar napreden pristop.
V Evropi Evropska agencija za zdravila (EMA) regulira xeno presaditve pod okvirom naprednih terapij zdravil (ATMP). EMA zahteva obsežno dokumentacijo o zdravju darovalca živali, genetskih modifikacijah in procesih proizvodnje. Agencija koordinira z nacionalnimi oblastmi, da zagotovi usklajeno nadzorovanje preko držav članic. Zanimivo je omeniti, da je EMA izdala znanstvene nasvete številnim podjetjem, ki razvijajo prašičje kožne presadke, kar pomeni naraščajoče regulativne angažiranosti na tem področju.
Države Azijsko-pacifiškega območja, zlasti Japonska in Južna Koreja, prav tako napredujejo pri regulativnih okvirih za xeno presaditev. Japonska agencija za zdravila in medicinske naprave (PMDA) je objavila smernice za klinično uporabo xeno tkiv, s poudarkom na nadzoru okužb in nadzoru po presaditvi. Ministrstvo za varnost hrane in zdravja v Južni Koreji (MFDS) prav tako posodablja svoje predpise, da bi prilagodilo nastajajočim tehnologijam xeno presaditve.
Na globalni ravni obstajajo pomembne razlike v regulativnih zahtevah, pri čemer nekatere države sprejemajo bolj dovolitne pristope k kliničnim preskušanjem, medtem ko druge vztrajajo pri strogih prepovedih xeno presaditve. Mednarodne organizacije, kot je Mednarodni svet za usklajevanje tehničnih zahtev za zdravila za ljudi (ICH), si prizadevajo za usklajevanje standardov, vendar ostajajo pomembne razlike.
V prihodnje se pričakuje, da se bo regulativna jasnost okrepila, ko bodo na voljo še več kliničnih podatkov in ko bodo podjetja, kot sta Revivicor in eGenesis, napredovala s svojimi programi genetsko inženiranih prašičjih kožnih presadkov. Regulativne agencije bodo najverjetneje posodobile smernice, da bi odražale nova znanstvena spoznanja, s stalnim poudarkom na varnosti pacientov, sledljivosti in dolgoročnem nadzoru. Razvijajoče se okolje bo zahtevalo tesno sodelovanje med industrijo, regulativnimi organi in znanstveno skupnostjo, da se zagotovi odgovorna in učinkovita preobrazba tehnologij xeno presaditve kože v klinično prakso.
Etične, varnostne in imunološke razmere v xeno presaditvi
Xeno presaditev kože — presaditev kože iz nečloveških vrst, predvsem genetsko spremenjenih prašičev, na ljudi — je v zadnjih letih hitro napredovala, vendar ostaja podvržena pomembnemu etičnemu, varnostnemu in imunološkemu pregledu. Leta 2025 se področje preusmerja iz predkliničnih študij v zgodnje klinične aplikacije, pri čemer se osredotoča na reševanje edinstvenih izzivov, ki jih prinaša presaditev med vrstami.
Osrednja etična skrb je povezana z uporabo genetsko inženiranih živali. Podjetja, kot sta Revivicor in eGenesis, so v ospredju, pri razvoju prašičev z večimi genetskimi popravki za zmanjšanje imunogenosti in tveganja prenosa zoonotskih bolezni. Te modifikacije, čeprav obetavne za zmanjšanje zavrnitve, postavljajo vprašanja o dobrobiti živali, dolgoročnem ekološkem vplivu in sprejemljivosti uporabe živalskih organov in tkiv za človeško korist. Regulativni organi v ZDA, EU in Aziji aktivno razvijajo okvirje za reševanje teh vprašanj, pri čemer poudarjajo preglednost, standarde dobrobiti živali in vključevanje javnosti.
Varnost ostaja ključna skrb, zlasti glede tveganja prenosa prašičjih endogenih retrovirusov (PERV) in drugih patogenov. Tako Revivicor kot eGenesis uporabljata napredne tehnologije urejanja genov, kot je CRISPR, za inaktivacijo zaporedij PERV v darovalnih prašičih. Zgodnji podatki iz leta 2025 iz predkliničnih in usmiljenih terapij kažejo, da te ukrepe pomembno zmanjšajo, a ne popolnoma odpravijo tveganja zoonoze. Nepretrgano spremljanje in strogi protokoli presejanja se izvajajo v vseh kliničnih protokolih, pod nadzorom nacionalnih zdravstvenih organov in organizacij, kot je Mednarodna asociacija za xeno presaditev.
Imunološka zavrnitev ostaja najbolj pomembna tehnična ovira. Človeški imunski sistem hitro in robustno reagira na xeno tkiva, kar vodi do hiperakutne in zakasnele zavrnitve. Da bi to rešili, podjetja inženirajo prašiče, da nimajo ključnih antigenov (kot je alfa-gal) in izražajo človeške regulativne proteine za komplement. V letih 2024 in 2025 so bila številna klinična preskušanja v zgodnjih fazah in usmiljeniški primeri pokazali začasno presaditev prašičje kože pri bolnikih z opeklinami, ki zagotavljajo kritično zaščito ran med čakanjem na autologno presaditev. Vendar pa dolgotrajno preživetje xeno presadkov ostaja neulovljivo, imunosupresivni režimi pa nosijo svoje izzive.
V prihodnje se pričakuje, da se bodo klinična preskušanja širila, izboljšalo pa se bo tudi genetsko inženirstvo darovalnih živali in razvijali se bodo bolj ciljno usmerjeni imunomodulatorni terapevti. Tudi področje se premika proti večjemu mednarodnemu usklajevanju etičnih in varnostnih standardov, pri čemer vodilna podjetja, kot sta Revivicor in eGenesis, sodelujejo z regulativnimi organi in bioetičnimi odbori, da zagotovijo odgovoren napredek. Obeti za xeno presaditev kože so previdno optimistični, z možnostjo za obravnavo kritičnih pomanjkljivosti v presadkih kože za hude opekline, pod pogojem, da se natančno obravnavajo etični, varnostni in imunološki izzivi.
Izvori, proizvodnja in izzivi skalabilnosti
Tehnologije xeno presaditve kože, ki vključujejo presaditev kože iz nečloveških virov (predvsem genetsko spremenjenih prašičev) v ljudi, hitro napredujejo leta 2025. Vendar pa se sektor sooča s pomembnimi izzivi na področju oskrbe, proizvodnje in skalabilnosti, ko prehaja iz eksperimentalnih in usmiljenih primerov v širšo klinično uporabo.
Ena od glavnih težav je zanesljivo in etično pridobivanje darovalnih živali. Podjetja, kot je Revivicor (podružnica United Therapeutics), so razvila genetsko inženirane prašične, zasnovane za minimizacijo imunskega odziva in zoonotskih tveganj. Ti prašiči zahtevajo visoko nadzorovano vzrejo, bivanje in nadzorne okolje za zagotavljanje biološke varnosti in genetske doslednosti, kar povečuje kompleksnost in stroške delovanja. Povečanje čred, da bi zadovoljili potencialno klinično povpraševanje, ob ohranjanju strogih standardov, ostaja ovira.
Proizvodnja xeno presadkov kože vključuje kompleksne bioprocesne korake, vključno s pobiranjem, decelularizacijo (v primeru uporabe acelularnih matriksov), sterilizacijo in ohranjanjem. Vsak korak mora biti v skladu s strogimi regulativnimi zahtevami za dobro proizvodno prakso (GMP). Revivicor in druge nastajajoče igralce vlagajo v specializirane bioproizvodne obrate, vendar so potrebna glavna sredstva in znanja, da se te operacije povečajo. Potreba po specializiranih čistih prostorih in validirani hladni verigi dodatno zapleta oskrbovalno verigo.
Drug izziv je usklajevanje med živalskimi objekti, obratmi za predelavo in kliničnimi lokacijami. Časovno občutljiva narava izdelkov iz živega tkiva zahteva robustno logistiko in sledenje v realnem času. Podjetja raziskujejo partnerstva s uveljavljenimi biopharmaceutical logističnimi ponudniki, da bi zagotovila pravočasno in varno dostavo, vendar je infrastruktura za obsežno, čezmejno distribucijo xeno tkiv še v začetnih fazah.
Regulativni nadzor dodaja še eno plast kompleksnosti. Agencije, kot je ameriška FDA, zahtevajo celovito sledljivost od darovalne živali do pacienta, vključno z dokumentacijo o genetskih modifikacijah, zdravstvenem stanju in korakih predelave. To zahteva napredne digitalne sledi in pregledno upravljanje oskrbovalne verige, kar mnoge podjetja še razvijajo.
V prihodnje se pričakuje, da se bo sektor spopadel z izboljšavami v skalabilnosti, saj se avtomatizacija, digitalizacija in integracija oskrbovalnih verig razvijajo. Podjetja, kot je United Therapeutics (matična družba Revivicor), vlagajo v vertikalno integrirane modele, da nadzorujejo celoten postopek od reje živali do klinične dobave. Vendar pa bo široka sprejetost odvisna od premagovanja trenutnih ovir v oskrbi živali, obdelovalnih zmogljivosti in regulativne usklajenosti med različnimi regijami. Naslednjih nekaj let bo ključnih za vzpostavitev robustnih, razširljivih oskrbovalnih verig, ki lahko podpirajo prehod xeno presaditve kože iz eksperimentalne terapije v rutinsko klinično prakso.
Konkurenčno okolje: Alografti, avtografti in sintetične alternative
Konkurenčno okolje za tehnologije xeno presaditve kože leta 2025 se hitro razvija, kar povzroča nujno potrebo po učinkovitih nadomestkih kože za zdravljenje hudih opeklin, kroničnih ran in rekonstrukcijske kirurgije. Tradicionalni pristopi — avtografti (lastna koža pacienta) in alografti (darovana človeška koža) — ostajajo klinični zlati standardi, vendar se oba soočata z pomembnimi omejitvami. Avtografti so omejeni zaradi morbiditete na mestu darovanja in omejene razpoložljivosti pri obsežnih poškodbah, medtem ko alografti prinašajo tveganja zavrnitve imunskega sistema in prenosa bolezni, pogosto pa so tudi v kratki zalogi.
V odgovor temu področje opazijo porast inovacij okoli xeno presaditve, zlasti s prašičjo (iz prašičev) kožo, ki zaradi svoje fiziološke podobnosti s človeško kožo omogoča skalabilno oskrbo. Podjetja, kot je Revivicor, podružnica United Therapeutics, so v ospredju in izkoriščajo napredno genetsko inženirstvo za proizvodnjo prašičev z zmanjšano imunogenostjo. Njihovo delo temelji na uspehu xeno presaditve v trdnih organih, pri čemer so genetsko spremenjeni prašiči zasnovani za minimizacijo hiperakutne zavrnitve in drugih imunskih odzivov. Leta 2024 je prašičev kožni presadek Revivicor vstopil v zgodnjo klinično oceno v izbranih centrih za opekline, pri čemer so začetni rezultati pokazali izboljšano preživetje presadkov in zmanjšane vnetne zaplete v primerjavi s konvencionalnimi xeno presadki.
Druga pomembna igralka je Genesis Biosciences, ki razvija decelularizirane poročne dermalne matrice. Ti izdelki nameravajo zagotoviti biokompatibilno podporo, ki podpira infiltracijo gostiteljskih celic in vaskularizacijo, pri čemer se zmanjša tveganje prenosa zoonotskih bolezni. Genesis Biosciences sodeluje z regulativnimi agencijami v ZDA in Evropi, da bi napredovali te izdelke skozi klinična preskušanja, s pomembnimi podatki, ki se pričakujejo do konca leta 2025.
Medtem se sintetične in biosintetične nadomestke kože še naprej konkurirajo na trgu, z uveljavljenimi podjetji, kot sta Smith & Nephew in Organogenesis, ki nudijo izdelke, kot sta Integra® in Dermagraft®. Te alternative zagotavljajo takojšnjo razpoložljivost in odpravljajo tveganje prenosa živalskih ali človeških bolezni, vendar pogosto nimajo celotne biološke funkcionalnosti živega tkiva in so morda manj učinkovite pri velikih ali kompleksnih ranah.
V prihodnjih letih se pričakuje, da se bo povečala konvergenca med xeno presaditvijo in naprednim tkivnim inženiringom. Podjetja raziskujejo integracijo genetsko spremenjenih prašičjih celic z bioaktivnimi podporami in tehnologijami 3D biotiskanja za ustvarjanje nadomestkov kože naslednje generacije. Regulativne poti se prav tako razvijajo, z agencijami, kot sta FDA in EMA, ki nudijo nove smernice za xenoženetske proizvode, kar bi lahko pospešilo vstop na trg za varne in učinkovite rešitve. Kot se kopičijo klinični podatki in se povečuje proizvodnja, so tehnologije xeno presaditve kože postavljene za to, da postanejo preobražajoča izbira v konkurentnem okolju oskrbe ran in rekonstrukcijske medicine.
Prihodnji obeti: Zasebni trendi, investicijski vroči kraji in dolgoročni vpliv
Xeno presaditev kože — presaditev kože iz nečloveških vrst na ljudi — stoji na prelomnem križišču leta 2025, motivirana z napredkom na področju genetskega inženirstva, imunomodulacije in bioproizvodnje. Področje se osredotoča predvsem na reševanje kritične pomanjkljivosti človeške darovane kože za žrtve hudih opeklin in bolnike s kroničnimi ranami. V zadnjih letih smo doživeli porast naložb in raziskav, saj številna podjetja in raziskovalni konsorci poskušajo potisniti meje tega, kar je mogoče.
Eden od glavnih disruptivnih trendov je uporaba genetsko spremenjene prašičje (prašiče) kože, ki je zasnovana za zmanjšanje imunogenosti in tveganja prenosa zoonotskih bolezni. Podjetja, kot je Revivicor — podružnica United Therapeutics — so pionirji pri razvoju multi-gene-edited prašičev, katerih tkiva so manj verjetna, da bi jih človeški imunski sistem zavrnil. V letih 2023 in 2024 so predklinične in zgodnje klinične študije pokazale, da si lahko prašičje kože presadki preživeli tedne pri človeških prejemnikih brez takojšnje zavrnitve, kar predstavlja pomemben napredek v primerjavi s prejšnjimi poskusi. Ti napredki so podprti z tehnologijami urejanja genov, kot je CRISPR, ki omogočajo natančno odstranitev antigenov in vstavitev genov, ki so združljivi z ljudmi.
Drug ključni igralec, eGenesis, izkorišča napredno urejanje genov za ustvarjanje prašičev z več kot 60 genetskimi modifikacijami, ki napadajo tako imunološko združljivost kot tudi odpravo prašičjih endogenih retrovirusov (PERV). Njihovo delo je pozorno spremljajo regulativne agencije in širša transplantacijska skupnost, saj postavlja temelje za prvo klinično preskušanje xeno presaditve kože v bližnji prihodnosti.
Investicijski vroči kraji se pojavljajo v Severni Ameriki, Evropi in Vzhodni Aziji, pri čemer javne in zasebne naložbe tečejo v uveljavljena biotehniška podjetja in akademsko-industrijska partnerstva. Ameriška agencija za hrano in zdravila (FDA) in Evropska agencija za zdravila (EMA) sta pokazali odprtost do pospešenih poti za xeno presaditvene produkte, pod pogojem, da so predstavljeni trdni podatki o varnosti in učinkovitosti. Ta regulativna fleksibilnost naj bi pospešila nadaljnje naložbe in klinično prevajanje.
V prihodnost se pričakuje, da bomo videli prva odobrena klinična preskušanja genetsko spremenjene prašičje kože za začasno pokritje ran, zlasti v primerih, kjer človeški alografti niso na voljo. Če bo to uspešno, bi ti proizvodi lahko preoblikovali aktualni standard oskrbe, zmanjšali smrtnost in obolevnost bolnikov z opeklinami po vsem svetu. Dolgoročno se lahko integracija xeno presaditve s tkivnim inženiringom — kot je kombinacija prašičjih podpor z človeškimi matičnimi celicami — pripelje do še naprednejših nadomestkov kože.
Vpliv teh tehnologij presega klinične izide. Obljubljajo, da bodo preoblikovali oskrbovalne verige, znižali stroške zdravstvene oskrbe in odprli nova tržišča za bioproizvedena tkiva. Ko se obravnavajo etični, regulativni in tehnični izzivi, je xeno presaditev kože pripravljena, da postane temelj regenerativne medicine do konca desetletja.
Viri in reference
- Revivicor
- United Therapeutics
- Xenothera
- eGenesis
- Organogenesis
- AVITA Medical
- Genopole
- European Medicines Agency
- International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use
- Genesis Biosciences
- Smith & Nephew