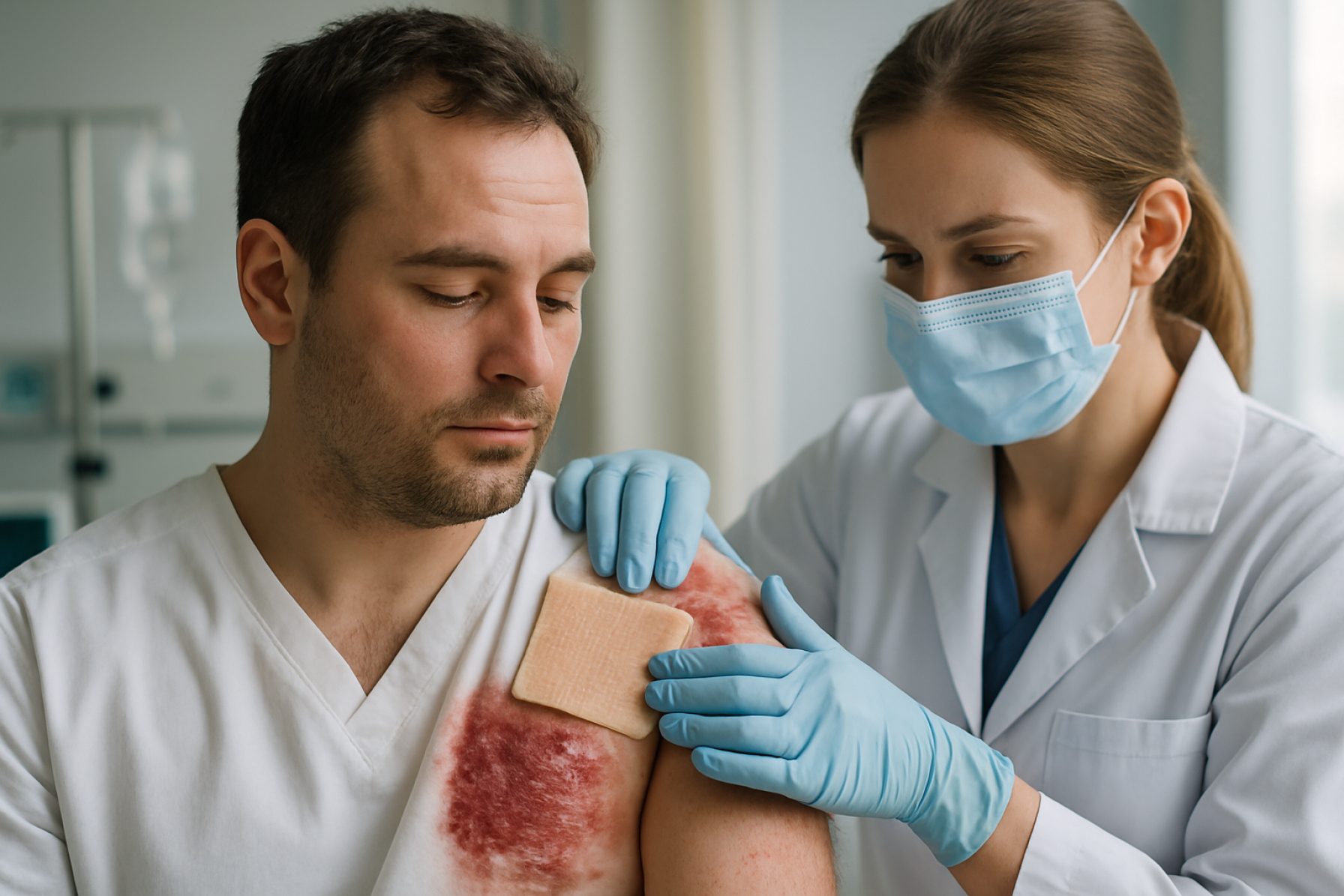
Tecnologias de Xenotransplante de Pele em 2025: Pioneirismo em Uma Nova Era para o Tratamento de Queimaduras Severas e Engenharia de Tecidos. Explore as Inovações, Forças de Mercado e Mudanças Regulárias que Estão Moldando os Próximos Cinco Anos.
- Resumo Executivo: O Estado do Xenotransplante de Pele em 2025
- Tamanho do Mercado, Previsões de Crescimento e Principais Motores (2025–2030)
- Inovações Tecnológicas: De Porcos Geneticamente Modificados a Enxertos Bioengenheirados
- Empresas Líderes e Instituições de Pesquisa: Perfis e Iniciativas Estratégicas
- Ensaios Clínicos e Aplicações no Mundo Real: Progresso e Resultados
- Paisagem Regulatória: Aprovações, Diretrizes e Variações Globais
- Considerações Éticas, de Segurança e Imunológicas no Xenotransplante
- Desafios de Cadeia de Suprimentos, Fabricação e Escalabilidade
- Cenário Competitivo: Aloenxertos, Autocontagios e Alternativas Sintéticas
- Perspectivas Futuras: Tendências Disruptivas, Pontos de Investimento e Impacto a Longo Prazo
- Fontes & Referências
Resumo Executivo: O Estado do Xenotransplante de Pele em 2025
O xenotransplante de pele—o transplante de pele de espécies não humanas para humanos—avançou rapidamente nos últimos anos, impulsionado por necessidades clínicas urgentes e avanços na engenharia genética. Em 2025, o campo está passando de casos experimentais e de uso compassivo para uma adoção clínica em estágio inicial, particularmente para vítimas de queimaduras severas e pacientes com perda extensa de pele onde enxertos de doadores humanos são insuficientes ou indisponíveis.
O progresso mais significativo foi feito com a pele porcina (suína) geneticamente modificada, que oferece uma alternativa escalável e imunologicamente compatível aos aloenxertos humanos. Empresas como Revivicor e eGenesis estão na vanguarda, aproveitando tecnologias avançadas de edição genética para remover antígenos suínos-chave que provocam rejeição imunológica humana. Em 2023 e 2024, ambas as empresas relataram ensaios pré-clínicos bem-sucedidos, demonstrando rejeição hipercutada reduzida e melhora na sobrevivência do enxerto em modelos de primatas não humanos. Esses resultados pavimentaram o caminho para os primeiros ensaios clínicos em humanos, que devem se expandir em 2025 e além.
Além disso, a Universal Skin e outras empresas de biotecnologia emergentes estão desenvolvendo linhagens de pele suína de “doador universal”, minimizando ainda mais a imunogenicidade e o risco de transmissão de doenças zoonóticas. Esses esforços são apoiados por protocolos rigorosos de triagem e inativação de patógenos, de acordo com as orientações regulatórias em evolução de agências como a Administração de Alimentos e Medicamentos dos EUA (FDA) e a Agência Europeia de Medicamentos (EMA).
A perspectiva clínica para o xenotransplante de pele em 2025 é cautelosamente otimista. Casos iniciais de uso compassivo nos Estados Unidos e na Europa mostraram que a pele de porco geneticamente modificada pode fornecer cobertura temporária para feridas, promover a cicatrização e reduzir o risco de infecção, com regimes de imunossupressão gerenciáveis. No entanto, a aceitação imunológica a longo prazo e a engraftment completa ainda representam desafios, e a maioria das aplicações está atualmente limitada a cobertura temporária em vez de enxertos permanentes.
Olhando para o futuro, espera-se que os próximos anos vejam:
- Expansão de ensaios clínicos para pele de porco geneticamente modificada em principais centros de queimadura em todo o mundo.
- Refinamento adicional das técnicas de edição gênica para melhorar a sobrevivência e segurança do enxerto.
- Aumento da colaboração entre empresas de biotecnologia, centros acadêmicos e órgãos reguladores para estabelecer protocolos padronizados e referências de segurança.
- Lançamento comercial potencial dos primeiros produtos de pele xenogênica aprovados para uso clínico, dependendo dos resultados dos ensaios e da revisão regulatória.
Em resumo, 2025 marca um ano decisivo para tecnologias de xenotransplante de pele, com líderes da indústria como Revivicor e eGenesis impulsionando a transição da inovação laboratorial para soluções clínicas no mundo real. Os próximos anos serão críticos para determinar a escalabilidade, segurança e aceitação dessas terapias transformadoras.
Tamanho do Mercado, Previsões de Crescimento e Principais Motores (2025–2030)
O mercado global para tecnologias de xenotransplante de pele está se preparando para um crescimento significativo entre 2025 e 2030, impulsionado por avanços na engenharia genética, aumento da incidência de queimaduras severas e feridas crônicas e uma persistente escassez de pele de doador humano. Em 2025, o setor permanece em uma fase pré-comercial ou inicial, com várias empresas e consórcios de pesquisa avançando com enxertos de pele porcinos geneticamente modificados em direção à aplicação clínica.
Os principais players neste espaço incluem Revivicor, uma subsidiária da United Therapeutics, que é pioneira no desenvolvimento de porcos geneticamente modificados para transplante de órgãos e tecidos. Seus porcos GalSafe™, projetados para eliminar o açúcar alfa-gal responsável pela rejeição hipercutada, receberam aprovação da FDA para uso alimentar e médico, estabelecendo as bases para xenografts de grau clínico. United Therapeutics continua a investir na escalabilidade da produção e no aprimoramento da compatibilidade imunológica para aplicações de pele.
Outra empresa notável é Xenothera, que está desenvolvendo soluções imunomodulatórias e tem pesquisa em andamento no xenotransplante, incluindo pele. Além disso, eGenesis está aproveitando a edição gênica CRISPR para criar tecidos porcos com múltiplas modificações genéticas para reduzir o risco de rejeição e transmissão de patógenos, com enxertos de pele como uma potencial aplicação.
O crescimento do mercado é sustentado pelo crescente ônus global de lesões por queimaduras—estimado em 11 milhões de pessoas anualmente em todo o mundo—e pela crescente prevalência de feridas crônicas, particularmente entre populações idosas e diabéticas. A limitada disponibilidade de enxertos de pele alogênicos (humanos), especialmente em cenários de múltiplas vítimas ou militares, acelera ainda mais a demanda por soluções alternativas, como xenografts.
A partir de 2025, espera-se que o mercado transite de casos experimentais e de uso compassivo para a adoção comercial inicial, particularmente em regiões com estruturas regulatórias avançadas e capacidades biomanufatureiras estabelecidas. A postura progressiva da FDA em relação ao xenotransplante, evidenciada por aprovações recentes, provavelmente catalisará caminhos regulatórios semelhantes na Europa e na Ásia-Pacífico.
Os principais motores de crescimento para 2025–2030 incluem:
- Avanços na edição gênica e triagem de patógenos, melhorando a segurança e compatibilidade do enxerto.
- Parcerias estratégicas entre empresas de biotecnologia, centros acadêmicos e provedores de saúde para acelerar ensaios clínicos e comercialização.
- Interesse do governo e do setor de defesa em estocar pele de xenograft para preparação de emergências.
- Aumento dos investimentos em infraestrutura de biomanufatura para permitir a produção escalável de pele suína de grau clínico.
Embora o mercado permaneça incipiente em 2025, as projeções indicam um robusto potencial de crescimento à medida que a eficácia clínica e segurança forem demonstradas, aprovações regulatórias se expandirem e a capacidade de manufatura escalar. Os próximos cinco anos provavelmente verão os primeiros produtos de pele xenograft comerciais chegarem a hospitais selecionados, com uma adoção mais ampla prevista à medida que os benefícios clínicos e econômicos forem validados.
Inovações Tecnológicas: De Porcos Geneticamente Modificados a Enxertos Bioengenheirados
O xenotransplante de pele—o transplante de pele de espécies não humanas para humanos—viu avanços tecnológicos significativos até 2025, impulsionados por necessidades clínicas urgentes, como queimaduras severas e feridas crônicas. O campo está evoluindo rapidamente, com foco em porcos geneticamente modificados e enxertos bioengenheirados projetados para superar barreiras imunológicas e melhorar a sobrevivência do enxerto.
Porcos geneticamente modificados se tornaram a principal fonte de pele xenogênica, devido às suas semelhanças fisiológicas com os humanos e à escalabilidade da reprodução suína. Empresas como Revivicor e EGEBiotech estão na vanguarda, engenheirando porcos com múltiplas edições gênicas para reduzir a expressão de antígenos responsáveis pela rejeição hipercutada. Essas modificações muitas vezes incluem a exclusão de genes que codificam para alfa-gal e outros xenoantígenos, além da inserção de proteínas reguladoras do complemento humano para mitigar ainda mais as respostas imunológicas.
Em 2023 e 2024, estudos pré-clínicos demonstraram que enxertos de pele desses porcos geneticamente modificados podiam sobreviver por várias semanas em primatas não humanos sem rejeição imediata, uma melhoria significativa em relação a tentativas anteriores. Ensaios clínicos em estágio inicial são esperados em 2025, com agências reguladoras monitorando de perto a segurança e eficiência. A Administração de Alimentos e Medicamentos dos EUA (FDA) forneceu orientações para protocolos de xenotransplante, e as empresas estão trabalhando para atender a esses requisitos rigorosos.
Paralelamente aos avanços na engenharia genética, enxertos de pele bioengenheirados estão ganhando espaço. Esses enxertos combinam matrizes extracelulares derivadas de porcos com células humanas ou andaimes sintéticos para criar construções híbridas que promovem integração e cicatrização. Organogenesis e AVITA Medical são players notáveis que desenvolvem tais produtos, aproveitando sua experiência em medicina regenerativa e cuidados com feridas. Suas tecnologias visam fornecer cobertura temporária ou permanente para feridas extensas, reduzindo o risco de infecções e melhorando os resultados para os pacientes.
Olhando para o futuro, espera-se que os próximos anos vejam os primeiros ensaios em humanos de enxertos de pele de porco com múltiplas edições gênicas, com foco em segurança, imunogenicidade e integração funcional. Avanços em ferramentas de edição gênica, como CRISPR/Cas9, provavelmente acelerarão o desenvolvimento de animais doadores ainda mais compatíveis. Além disso, a integração da bioimpressão 3D e engenharia de tecidos pode permitir a personalização de enxertos para atender às necessidades específicas dos pacientes, aumentando ainda mais a utilidade clínica das tecnologias de xenotransplante.
No geral, a convergência da engenharia genética, engenharia de tecidos e progresso regulatório posiciona o xenotransplante de pele como uma solução promissora para necessidades médicas críticas não atendidas, com 2025 se profilando como um ano crucial para a tradução clínica e comercialização.
Empresas Líderes e Instituições de Pesquisa: Perfis e Iniciativas Estratégicas
O xenotransplante de pele—o uso de enxertos de pele derivados de animais para o cuidado de feridas humanas—avançou rapidamente, com várias empresas e instituições de pesquisa na vanguarda da tradução de avanços pré-clínicos em realidades clínicas e comerciais. Em 2025, o setor é caracterizado por uma mistura de empresas de biotecnologia estabelecidas, novas startups inovadoras e colaborações acadêmicas, todas mirando em atender à escassez global de pele de doador humano para queimaduras severas e feridas crônicas.
Um líder global em xenotransplante, Revivicor (uma subsidiária da United Therapeutics Corporation) aproveitou sua expertise na engenharia genética de porcos para desenvolver tecidos suínos com imunogenicidade reduzida. Embora a Revivicor seja mais conhecida por seu trabalho em xenotransplante de órgãos sólidos, seus porcos GalSafe—engenheirados para não possuírem o açúcar alfa-gal responsável pela rejeição hipercutada—também estão sendo explorados como fontes para enxertos de pele. As colaborações em andamento da empresa com centros acadêmicos médicos devem gerar dados clínicos iniciais sobre a segurança e eficácia de enxertos de pele de porco nos próximos anos.
Outro player proeminente, Genopole, o principal biocluster da França para inovação genética e biotecnológica, apoia várias startups e grupos de pesquisa focados em xenotransplante. Através de seu incubador e programas de financiamento, Genopole promove o desenvolvimento de modelos animais geneticamente modificados e plataformas avançadas de engenharia de tecidos, com ênfase particular em imunomodulação e controle de infecções para enxertos de pele.
Na Ásia, a Sinogene Biotechnology expandiu seu portfólio de clonagem de animais para o desenvolvimento de porcos geneticamente modificados para aplicações biomédicas, incluindo xenografts de pele. A divisão de pesquisa da empresa está colaborando ativamente com hospitais chineses para iniciar ensaios clínicos de pele suína para pacientes com queimaduras, com submissões regulatórias previstas para 2026.
Instituições acadêmicas continuam sendo fundamentais para o avanço do campo. O Centro de Transplantes do Massachusetts General Hospital (MGH), em parceria com empresas de biotecnologia, está conduzindo estudos pré-clínicos sobre regimes imunossupressores e pele suína editada geneticamente. A pesquisa do MGH deverá informar o design de ensaios em humanos nos Estados Unidos, que podem começar nos próximos dois a três anos.
Olhando para o futuro, iniciativas estratégicas por parte dessas organizações se concentram em refinar modificações genéticas para minimizar a rejeição, aumentar a criação de animais livres de patógenos e navegar nas estruturas regulatórias em evolução. Os próximos anos provavelmente verão os primeiros ensaios clínicos controlados de pele suína editada geneticamente, com potencial para transformar o cuidado com queimaduras e gerenciamento de feridas em nível global.
Ensaios Clínicos e Aplicações no Mundo Real: Progresso e Resultados
O xenotransplante de pele—o transplante de pele de espécies não humanas, principalmente porcos geneticamente modificados, para humanos—avançou rapidamente nos últimos anos, com 2025 marcando um período decisivo para tradução clínica e aplicação no mundo real. A tecnologia aborda a escassez crítica de enxertos autólogos e alogênicos para vítimas de queimaduras severas e pacientes com perda extensiva de pele, oferecendo uma linha potencial onde a pele de doador humano não está disponível.
Em 2024 e 2025, vários ensaios clínicos em fase inicial foram iniciados ou estão em andamento, focando na segurança, imunogenicidade e eficácia de enxertos de pele derivados de porco. Notavelmente, Xenothera, uma empresa de biotecnologia francesa, tem estado na vanguarda, aproveitando sua expertise em imunomodulação e engenharia genética para desenvolver enxertos de pele suína com imunogenicidade reduzida. Seus estudos pré-clínicos demonstraram resultados promissores na minimização da rejeição aguda, e em 2025, espera-se que a empresa reporte dados intermediários de seus primeiros ensaios em humanos.
Outro player-chave, Revivicor (uma subsidiária da United Therapeutics), desenvolveu porcos com múltiplas edições gênicas cujos tecidos foram projetados para serem mais compatíveis com o sistema imunológico humano. Em 2024, os enxertos de pele suína da Revivicor entraram em protocolos de uso compassivo em centros de queimaduras selecionados nos EUA, com resultados iniciais indicando melhor sobrevivência do enxerto e necessidade reduzida de imunossupressão em comparação com gerações anteriores de xenografts. A empresa está colaborando com centros acadêmicos médicos para lançar ensaios formais de Fase I/II em 2025, focando tanto no cuidado agudo de queimaduras quanto no manejo de feridas crônicas.
Na Ásia, a Sinogene, uma empresa chinesa de biotecnologia especializada em engenharia genética animal, anunciou o desenvolvimento de porcos editados geneticamente para xenotransplante de pele. Em 2025, a Sinogene deve iniciar estudos clínicos piloto em colaboração com grandes hospitais chineses, visando enfrentar a alta incidência de queimaduras severas na região.
As aplicações no mundo real permanecem limitadas a ambientes clínicos altamente regulados, com rigoroso controle por parte das autoridades de saúde nacionais. Dados iniciais de programas de uso compassivo e acesso expandido sugerem que enxertos de pele de porco geneticamente modificados podem fornecer cobertura temporária eficaz para feridas, reduzir taxas de infecção e facilitar a cicatrização até que o enxerto autólogo seja possível. No entanto, os resultados a longo prazo, incluindo rejeição crônica e risco zoonótico, ainda estão sob investigação cuidadosa.
Olhando para o futuro, espera-se que os próximos anos vejam a expansão de ensaios clínicos, o refinamento de modificações genéticas para reduzir ainda mais a imunogenicidade e o desenvolvimento de protocolos padronizados para aplicação do xenograft. Agências reguladoras nos EUA, Europa e Ásia estão monitorando de perto esses desenvolvimentos, com potencial para aprovações condicionais se os ensaios em andamento continuarem a demonstrar segurança e eficácia. O campo está posicionado para avanços significativos, com a promessa de transformar o cuidado com queimaduras e feridas em nível global.
Paisagem Regulatória: Aprovações, Diretrizes e Variações Globais
A paisagem regulatória para tecnologias de xenotransplante de pele está rapidamente evoluindo à medida que os avanços científicos aproximam esses produtos da aplicação clínica. Em 2025, agências reguladoras em todo o mundo estão ativamente desenvolvendo e refinando estruturas para abordar os desafios únicos apresentados pelos enxertos de pele xenogênica, particularmente aqueles derivados de porcos geneticamente modificados. Esses desafios incluem preocupações sobre a transmissão de doenças zoonóticas, compatibilidade imunológica, considerações éticas e monitoramento de segurança a longo prazo.
Nos Estados Unidos, a Administração de Alimentos e Medicamentos dos EUA (FDA) estabeleceu diretrizes para produtos de xenotransplante, exigindo dados pré-clínicos e clínicos rigorosos para demonstrar segurança e eficácia. O Centro de Avaliação e Pesquisa de Biológicos da FDA (CBER) supervisiona o caminho regulatório para esses produtos, enfatizando a necessidade de avaliações de risco abrangentes, incluindo o potencial para transmissão de vírus retrovíricos endógenos suínos (PERV). Nos últimos anos, a FDA concedeu aprovações de Investigational New Drug (IND) para ensaios clínicos em fase inicial de enxertos de pele suína geneticamente modificados, refletindo uma postura cautelosa, mas progressiva.
Na Europa, a Agência Europeia de Medicamentos (EMA) regulamenta o xenotransplante sob a estrutura de Produtos Medicinais de Terapia Avançada (ATMP). A EMA exige documentação extensa sobre a saúde do animal doador, modificações genéticas e processos de fabricação. A agência também coordena com autoridades nacionais para garantir supervisão harmonizada entre os estados-membros. Notavelmente, a EMA emitiu conselhos científicos a várias empresas que desenvolvem enxertos de pele suína, sinalizando um crescente engajamento regulatório neste campo.
Os países da Ásia-Pacífico, especialmente Japão e Coreia do Sul, também estão avançando com estruturas regulatórias para xenotransplante. A Agência de Produtos Farmacêuticos e Dispositivos Médicos do Japão (PMDA) publicou diretrizes para o uso clínico de tecidos xenogênicos, com foco no controle de infecções e vigilância pós-transplante. O Ministério de Segurança Alimentar e Medicamentos da Coreia do Sul (MFDS) também está atualizando suas regulamentações para acomodar tecnologias emergentes de xenotransplante.
Globalmente, há uma variação significativa nos requisitos regulatórios, com alguns países adotando abordagens mais permissivas para ensaios clínicos, enquanto outros mantêm proibições rigorosas sobre xenotransplante. Organizações internacionais, como o Conselho Internacional para Harmonização de Requisitos Técnicos para Produtos Farmacêuticos para Uso Humano (ICH), estão trabalhando para promover a harmonização de padrões, mas diferenças substanciais permanecem.
Olhando para o futuro, espera-se que os próximos anos vejam um aumento da clareza regulatória à medida que mais dados clínicos se tornem disponíveis e empresas como Revivicor e eGenesis avancem em seus programas de enxertos de pele suína geneticamente modificada. As agências reguladoras provavelmente atualizarão as diretrizes para refletir novas descobertas científicas, com uma ênfase contínua na segurança do paciente, rastreabilidade e monitoramento a longo prazo. A paisagem em evolução exigirá uma estreita colaboração entre a indústria, reguladores e a comunidade científica para garantir uma tradução responsável e eficaz das tecnologias de xenotransplante de pele para a prática clínica.
Considerações Éticas, de Segurança e Imunológicas no Xenotransplante
O xenotransplante de pele—o transplante de pele de espécies não humanas, principalmente porcos geneticamente modificados, para humanos—avançou rapidamente nos últimos anos, mas permanece sujeito a um exame ético, de segurança e imunológico significativo. Em 2025, o campo está passando de estudos pré-clínicos para aplicações clínicas em estágio inicial, com foco em abordar os desafios únicos apresentados pelo transplante entre espécies.
Uma preocupação ética primária gira em torno do uso de animais geneticamente modificados. Empresas como Revivicor e eGenesis estão na vanguarda, desenvolvendo porcos com múltiplas edições gênicas para reduzir a imunogenicidade e o risco de transmissão de doenças zoonóticas. Essas modificações, embora promissoras para reduzir a rejeição, levantam questões sobre o bem-estar animal, impactos ecológicos a longo prazo e a aceitabilidade do uso de órgãos e tecidos animais para o benefício humano. Órgãos reguladores nos EUA, UE e Ásia estão ativamente desenvolvendo estruturas para abordar essas questões, enfatizando transparência, padrões de bem-estar animal e engajamento público.
A segurança permanece uma preocupação primordial, especialmente em relação ao risco de transmissão de retrovírus endógenos suínos (PERVs) e outros patógenos. Tanto Revivicor quanto eGenesis empregam tecnologias avançadas de edição gênica, como CRISPR, para inativar sequências de PERV em porcos doadores. Dados de 2025 de casos pré-clínicos e de uso compassivo sugerem que essas medidas reduzem significativamente, mas não eliminam totalmente, o risco de zoonose. Vigilância contínua e protocolos de triagem rigorosos estão sendo implementados em todos os protocolos clínicos, com supervisão de autoridades de saúde nacionais e organizações como a Associação Internacional de Xenotransplante.
A rejeição imunológica continua sendo a barreira técnica mais significativa. O sistema imunológico humano monta uma resposta rápida e robusta aos tecidos xenogênicos, levando à rejeição hipercutada e tardia. Para abordar isso, as empresas estão engenheirando porcos para carecer de antígenos-chave (como a alfa-gal) e para expressar proteínas reguladoras do complemento humano. Em 2024 e 2025, vários ensaios clínicos em fase inicial e casos de uso compassivo demonstraram engraftment temporário de pele suína em pacientes queimados, proporcionando cobertura crítica de feridas enquanto aguardavam o enxerto autólogo. No entanto, a sobrevivência a longo prazo dos xenografts continua elusiva e regimes imunossupressores acarretam seus próprios riscos.
Olhando para o futuro, os próximos anos provavelmente verão ensaios clínicos expandidos, melhorias na engenharia genética de animais doadores e o desenvolvimento de terapias imunomodulatórias mais direcionadas. O campo também está avançando em direção a uma maior harmonização internacional dos padrões éticos e de segurança, com líderes da indústria como Revivicor e eGenesis colaborando com agências reguladoras e comitês de bioética para garantir um progresso responsável. A perspectiva para o xenotransplante de pele é cautelosamente otimista, com potencial para abordar a escassez crítica de enxertos de pele para queimaduras severas, desde que questões éticas, de segurança e imunológicas continuem sendo rigorosamente tratadas.
Desafios de Cadeia de Suprimentos, Fabricação e Escalabilidade
As tecnologias de xenotransplante de pele, que envolvem o transplante de pele de fontes não humanas (principalmente porcos geneticamente modificados) para humanos, estão avançando rapidamente em 2025. No entanto, o setor enfrenta desafios significativos de cadeia de suprimentos, fabricação e escalabilidade à medida que avança de casos experimentais e de uso compassivo para aplicação clínica mais ampla.
Um dos principais desafios é a obtenção confiável e ética de animais doadores. Empresas como Revivicor (uma subsidiária da United Therapeutics) desenvolveram porcos geneticamente modificados projetados para minimizar a rejeição imunológica e os riscos zoonóticos. Esses porcos requerem ambientes de reprodução, alojamento e monitoramento altamente controlados para garantir biossegurança e consistência genética, o que aumenta a complexidade operacional e os custos. A ampliação de rebanhos para atender à demanda clínica potencial, enquanto mantém padrões rigorosos, continua sendo um gargalo.
A fabricação de enxertos de pele xenogênicos envolve etapas complexas de bioprocessamento, incluindo colheita, descelularização (se usando matrizes acelulares), esterilização e preservação. Cada etapa deve cumprir requisitos regulatórios rigorosos para Boas Práticas de Fabricação (GMP). A Revivicor e outros players emergentes estão investindo em instalações dedicadas de biomanufatura, mas o capital e a expertise necessários para escalar essas operações são substanciais. A necessidade de ambientes limpos especializados e logística de cadeia fria validada complica ainda mais a cadeia de suprimentos.
Outro desafio é a coordenação entre instalações de animais, plantas de processamento e locais clínicos. A natureza sensível ao tempo dos produtos de tecido vivo exige logística robusta e rastreamento em tempo real. As empresas estão explorando parcerias com provedores estabelecidos de logística biofarmacêutica para garantir entrega oportuna e segura, mas a infraestrutura para a distribuição em larga escala e transfronteiriça de tecidos xenogênicos ainda é incipiente.
A supervisão regulatória acrescenta mais uma camada de complexidade. Agências como a Administração de Alimentos e Medicamentos dos EUA (FDA) exigem rastreabilidade abrangente do animal doador ao paciente, incluindo documentação de modificações genéticas, saúde e etapas de processamento. Isso exige sistemas de rastreamento digital avançados e gerenciamento transparente da cadeia de suprimentos, que muitas empresas ainda estão desenvolvendo.
Olhando para o futuro, espera-se que o setor veja melhorias incrementais na escalabilidade à medida que a automação, digitalização e integração da cadeia de suprimentos amadureçam. Empresas como United Therapeutics (mãe da Revivicor) estão investindo em modelos verticalmente integrados para controlar todo o processo, desde a criação de animais até a entrega clínica. No entanto, a adoção generalizada dependerá de superar os atuais gargalos na oferta de animais, capacidade de bioprocessamento e harmonização regulatória entre regiões. Os próximos anos serão críticos para estabelecer cadeias de suprimentos robustas e escaláveis que possam apoiar a transição do xenotransplante de pele de terapia experimental para prática clínica rotineira.
Cenário Competitivo: Aloenxertos, Autocontagios e Alternativas Sintéticas
O cenário competitivo para tecnologias de xenotransplante de pele em 2025 está evoluindo rapidamente, impulsionado pela necessidade urgente de substitutos de pele eficazes no cuidado de queimaduras severas, feridas crônicas e cirurgia reconstrutiva. Abordagens tradicionais—autografts (pele do próprio paciente) e allografts (pele de doador humano)—permanecem como os padrões clínicos, mas ambos enfrentam limitações significativas. Os autografts são restritos pela morbidade do local doador e disponibilidade limitada em lesões extensas, enquanto os aloenxertos apresentam riscos de rejeição imunológica e transmissão de doenças, frequentemente em oferta limitada.
Em resposta, o campo está testemunhando um aumento na inovação em torno do xenotransplante, particularmente com pele porcina (derivada de porco), devido à sua semelhança fisiológica com a pele humana e disponibilidade escalável. Empresas como Revivicor, uma subsidiária da United Therapeutics, estão na vanguarda, aproveitando engenharia genética avançada para produzir porcos com imunogenicidade reduzida. Seu trabalho se baseia no sucesso do xenotransplante em órgãos sólidos, com porcos geneticamente modificados projetados para minimizar a rejeição hipercutada e outras respostas imunes. Em 2024, os enxertos de pele suína da Revivicor entraram em avaliação clínica inicial em centros de queimadura selecionados, com resultados iniciais indicando melhor sobrevivência do enxerto e complicações inflamatórias reduzidas em comparação com xenografts convencionais.
Outro jogador notável é a Genesis Biosciences, que está desenvolvendo matrizes dérmicas porcinas descelularizadas. Esses produtos visam fornecer um andaime biocompatível que apoie a infiltração celular do hospedeiro e a vascularização, ao mesmo tempo que minimiza o risco de transmissão de doenças zoonóticas. A Genesis Biosciences está colaborando com agências reguladoras nos EUA e Europa para avançar esses produtos em ensaios clínicos, com dados-chave esperados para o final de 2025.
Enquanto isso, substitutos dérmicos sintéticos e biosintéticos continuam a competir no mercado, com empresas estabelecidas como Smith & Nephew e Organogenesis oferecendo produtos como Integra® e Dermagraft®, respectivamente. Essas alternativas oferecem disponibilidade imediata e eliminam o risco de transmissão de doenças de animais ou humanos, mas muitas vezes carecem da funcionalidade biológica completa do tecido vivo e podem ser menos eficazes em feridas grandes ou complexas.
Olhando para o futuro, espera-se que os próximos anos vejam uma maior convergência entre o xenotransplante e a engenharia de tecidos avançada. Empresas estão explorando a integração de células porcinas editadas geneticamente com andaimes bioativos e tecnologias de bioimpressão 3D para criar substitutos dérmicos de próxima geração. Os caminhos regulatórios também estão evoluindo, com agências como a FDA e EMA oferecendo novas orientações para produtos xenogênicos, potencialmente acelerando a entrada no mercado para soluções seguras e eficazes. À medida que os dados clínicos se acumulam e a manufatura se expande, as tecnologias de xenotransplante de pele estão posicionadas para se tornarem uma opção transformadora no panorama competitivo de cuidados com feridas e medicina reconstrutiva.
Perspectivas Futuras: Tendências Disruptivas, Pontos de Investimento e Impacto a Longo Prazo
O xenotransplante de pele—o transplante de pele de espécies não humanas para humanos—está em um ponto crucial em 2025, impulsionado por avanços em engenharia genética, imunomodulação e biomanufatura. O campo tem como foco principal abordar a escassez crítica de pele de doador humano para vítimas de queimaduras severas e pacientes com feridas crônicas. Nos últimos anos, houve um aumento no investimento e pesquisa, com várias empresas e consórcios de pesquisa levando os limites do que é possível.
Uma da principais tendências disruptivas é o uso de pele de porco (suína) geneticamente modificada, projetada para reduzir a imunogenicidade e o risco de transmissão de doenças zoonóticas. Empresas como Revivicor—uma subsidiária da United Therapeutics—pioneiram o desenvolvimento de porcos com múltiplas edições gênicas cujos tecidos têm menor probabilidade de serem rejeitados pelo sistema imunológico humano. Em 2023 e 2024, estudos pré-clínicos e clínicos iniciais demonstraram que enxertos de pele suína poderiam sobreviver por semanas em receptores humanos sem rejeição imediata, uma grande evolução em relação a tentativas anteriores. Esses avanços são sustentados pelas tecnologias de edição gênica como CRISPR, que permitem a remoção precisa de antígenos e inserção de genes compatíveis com humanos.
Outro jogador chave, eGenesis, está aproveitando a edição gênica avançada para criar porcos com mais de 60 modificações genéticas, visando tanto a compatibilidade imunológica quanto a eliminação de retrovírus endógenos suínos (PERVs). Seu trabalho é cuidadosamente monitorado por agências reguladoras e pela comunidade de transplantes mais ampla, pois estabelece o cenário para os primeiros ensaios em humanos de pele xenogênica em um futuro próximo.
Pontos de investimento estão surgindo na América do Norte, Europa e Leste Asiático, com financiamento público e privado fluindo tanto para empresas de biotecnologia estabelecidas quanto para parcerias acadêmico-industriais. A Administração de Alimentos e Medicamentos dos EUA (FDA) e a Agência Europeia de Medicamentos (EMA) sinalizaram abertura para caminhos acelerados para produtos de xenotransplante, fornecidos dados robustos de segurança e eficácia sejam apresentados. Essa flexibilidade regulatória deve catalisar mais investimentos e tradução clínica.
Olhando para o futuro, os próximos anos provavelmente verão os primeiros ensaios clínicos aprovados de pele de porco editada geneticamente para cobertura temporária de feridas, especialmente em casos em que aloenxertos humanos não estão disponíveis. Se bem-sucedidos, esses produtos podem interromper o padrão de cuidado atual, reduzindo a mortalidade e morbidade para pacientes queimados em todo o mundo. A longo prazo, a integração do xenotransplante com a engenharia de tecidos—como a combinação de andaimes suínos com células-tronco humanas—pode gerar substitutos dérmicos ainda mais avançados.
O impacto dessas tecnologias se estende além dos resultados clínicos. Elas prometem remodelar cadeias de suprimento, reduzir custos de saúde e abrir novos mercados para tecidos biofabricados. À medida que os desafios éticos, regulatórios e técnicos são abordados, o xenotransplante de pele está posicionado para se tornar um pilar da medicina regenerativa até o final da década.
Fontes & Referências
- Revivicor
- United Therapeutics
- Xenothera
- eGenesis
- Organogenesis
- AVITA Medical
- Genopole
- Agência Europeia de Medicamentos
- Conselho Internacional para Harmonização de Requisitos Técnicos para Produtos Farmacêuticos para Uso Humano
- Genesis Biosciences
- Smith & Nephew