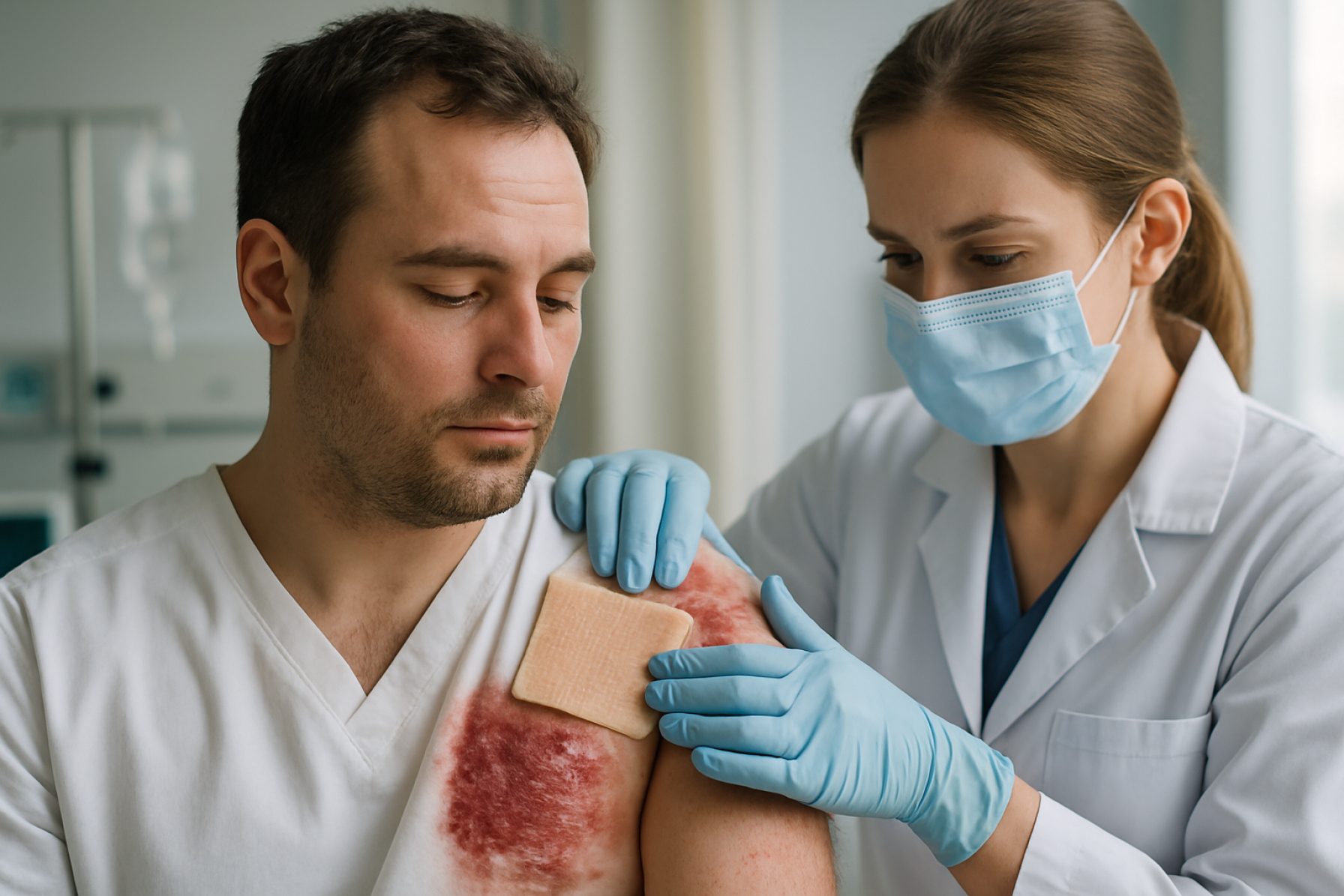
A bőr xenotranszplantációs technológiái 2025: Új korszak kezdetét jelzi a súlyos égési sérülések kezelésében és a szövetmérnöki alkalmazásokban. Ismerje meg az innovációkat, a piaci erőket és a szabályozási változásokat, amelyek alakítják a következő öt évet.
- Vezető Összegzés: A bőr xenotranszplantáció állapota 2025-ben
- Piacméret, növekedési előrejelzések és kulcsfontosságú tényezők (2025–2030)
- Technológiai innovációk: Genetikailag módosított disznóktól a bioengineered graftokig
- Vezető cégek és kutatóintézetek: Profilok és stratégiai kezdeményezések
- Klinikai kísérletek és valós alkalmazások: Haladások és eredmények
- Szabályozási környezet: Engedélyek, irányelvek és globális eltérések
- Etikai, biztonsági és immunológiai megfontolások a xenotranszplantációban
- Ellátási lánc, gyártási és skálázhatósági kihívások
- Versenyhelyzet: Allograftok, autograftok és szintetikus alternatívák
- Jövőbeli kilátások: Zavaró tendenciák, befektetési középpontok és hosszú távú hatás
- Források és hivatkozások
Vezető Összegzés: A bőr xenotranszplantáció állapota 2025-ben
A bőr xenotranszplantáció – bőr átültetése nem emberi fajokból emberekbe – az utóbbi években gyorsan fejlődött, sürgős klinikai igények és áttörések a genetikai mérnökség terén. 2025-re a terület az empirikus és együttérző használati esetekből a korai szakaszú klinikai elfogadás felé halad, különösen a súlyos égési sérült betegek és a kiterjedt bőrkieséssel küzdő páciensek esetében, ahol az emberi donor graftok nem elegendőek vagy nem állnak rendelkezésre.
A legjelentősebb előrelépés a genetikailag módosított sertés (disznó) bőrrel valósult meg, amely skálázható és immunológiailag kompatibilis alternatívát kínál az emberi allograftokkal szemben. Az olyan cégek, mint a Revivicor és az eGenesis, az élen járnak, kihasználva a fejlett géni szerkesztési technológiákat, hogy eltávolítsák azokat a kulcsfontosságú sertésspecifikus antigéneket, amelyek az emberi immunrendszer elutasítását kiváltják. 2023-ban és 2024-ben mindkét cég sikeres preklinikai vizsgálatokat számolt be, amelyek csökkentett hyperacute elutasítást és javított graft túlélést mutattak nem emberi primátus modellben. Ezek az eredmények utat nyitottak az első, emberi betegek körében végzett klinikai vizsgálatok számára, amelyek várhatóan 2025-ben és azután bővülnek.
Párhuzamosan az Universal Skin és más feltörekvő biotechnológiai cégek dolgoznak az „univerzális donor” sertés bőrsorozatok kifejlesztésén, tovább minimalizálva az immunogenitást és a zoonózis kockázatát. Ezeket az erőfeszítéseket szigorú szűrési és kórokozók inaktiválási protokollok támogatják, összhangban a fejlődő szabályozási irányelvekkel, például az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatalától (FDA) és az Európai Gyógyszerügynökségtől (EMA).
A klinikai kilátások a bőr xenotranszplantációjára 2025-re óvatosan optimisták. Az Egyesült Államokban és Európában korai együttérző használati esetek megmutatták, hogy a genetikailag módosított sertés bőr ideiglenes sebelfedést nyújthat, elősegítheti a gyógyulást és csökkentheti a fertőzés kockázatát, kezelhető immunsuppresziós rendszerekkel. Ugyanakkor a hosszú távú beültetés és a teljes immunológiai elfogadás továbbra is kihívások elé állítja a szakembereket, és a legtöbb alkalmazás jelenleg ideiglenes fedésre korlátozódik, nem pedig végleges graftokra.
A jövőt illetően az elkövetkező néhány évben várható:
- A klinikai vizsgálatok bővítése genetikailag módosított sertés bőr számára a világ fő égési központjában.
- A génszerkesztési technikák további finomítása a graft túlélés és biztonság javítása érdekében.
- Növekvő együttműködés a biotechnológiai cégek, egyetemi központok és szabályozó testületek között a szabványosított protokollok és biztonsági irányelvek létrehozására.
- Az első engedélyezett xenogén bőráru kereskedelmi forgalomban történő bevezetése a klinikai használatra, a vizsgálati eredmények és a szabályozói felülvizsgálat függvényében.
Összefoglalva, 2025 fordulóponti év a bőr xenotranszplantációs technológiák számára, ahol az iparági vezetők, mint a Revivicor és az eGenesis, a laboratóriumi innovációk átjárásának élén állnak a valós klinikai megoldások felé. Az elkövetkező évek kulcsszerepet játszanak a hasonló terápiák skálázhatóságának, biztonságának és elfogadottságának meghatározásában.
Piacméret, növekedési előrejelzések és kulcsfontosságú tényezők (2025–2030)
A globális piaca a bőr xenotranszplantációs technológiáknak jelentős növekedés előtt áll 2025 és 2030 között, amelyet a genetikai mérnöki előrelépések, a súlyos égési sérülések és krónikus sebek növekvő előfordulása, valamint a humán donor bőr folyamatos hiánya hajt. 2025-re a szektor még mindig kísérleti vagy korai kereskedelmi fázisban van, néhány cég és kutatási konzorcium a genetikailag módosított sertés bőr graftokat klinikai alkalmazásra fejleszti.
A piacon kulcsszereplők közé tartozik a Revivicor, az United Therapeutics leányvállalata, amely úttörő szerepet játszott a szervek és szövetek xenotranszplantációjára szolgáló genetikailag módosított sertések kifejlesztésében. GalSafe™ sertéseik, amelyek célja az alpha-gal cukor eliminálása, amely a hyperacute elutasítást okozza, FDA engedélyt kaptak élelmiszer- és orvosi felhasználásra, megalapozva a klinikai minőségű xenograftok előállítását. Az United Therapeutics folytatja a termelés növelésére és az immunológiai kompatibilitás finomítására tett befektetéseit a bőr alkalmazások terén.
Egy másik figyelemre méltó cég a Xenothera, amely immunomoduláló megoldásokat fejleszt, és folytatja a xenotranszplantációval kapcsolatos kutatásokat, beleértve a bőrt is. Ezenkívül az eGenesis kihasználja a CRISPR génszerkesztést, hogy sertés szöveteket hozzon létre, amelyek több genetikai módosítást tartalmaznak az elutasítás és a kórokozó átvitel kockázatának csökkentésére, a bőr graftokkal mint lehetséges alkalmazás.
A piaci növekedést a globális égési sérülések növekvő terhe is alátámasztja, amely évente körülbelül 11 millió embert érint világszerte, valamint a krónikus sebek növekvő előfordulása, különösen az öregedő népesség és a cukorbetegségben szenvedők körében. Az allogén (humán) bőr graftok korlátozott rendelkezésre állása, különösen tömeges balesetet vagy katonai helyzeteket figyelembe véve, tovább gyorsítja az alternatív megoldások, például a xenograftok iránti keresletet.
2025-től a piac várhatóan átáll a kísérleti és együttérző használati esetekből a korai kereskedelmi elfogadásra, különösen olyan régiókban, ahol fejlett szabályozási keretek és megalapozott biogyártási képességek állnak rendelkezésre. Az Egyesült Államok FDA-jának előremutató álláspontja a xenotranszplantációval kapcsolatban, amely az újabb engedélyezésekből is nyilvánvaló, valószínűleg hasonló szabályozási utakat katalizál Európában és Ázsia-Pacific térségében.
A 2025-2030 közötti növekedési hajtóerők közé tartoznak:
- A génszerkesztési és kórokozó szűrési technológiák fejlesztése, a graftok biztonságának és kompatibilitásának javítása érdekében.
- Stratégiai partnerségek a biotechnológiai vállalatok, egyetemi központok és egészségügyi szolgáltatók között a klinikai vizsgálatok és a kereskedelmi tevékenységek felgyorsítása érdekében.
- Kormányzati és védelmi szektor érdeklődése a xenograft bőr készletezése iránt a sürgősségek előkészítése érdekében.
- Folyamatos befektetések a biogyártási infrastruktúrába a klinikai minőségű sertés bőr skálázható termelésének lehetővé tétele érdekében.
Bár a piac 2025-re még nascent fázisban marad, a becslések arra utalnak, hogy erős növekedési potenciál áll rendelkezésre, mivel a klinikai hatékonyság és biztonság demonstrálva van, a szabályozási engedélyek bővülnek és a gyártási kapacitás bővül. A következő öt évben várhatóan az első kereskedelmi xenograft bőr termékek eljutnak néhány kórházba, míg a szélesebb körű elfogadás várhatóan a klinikai és gazdasági előnyök megerősítésével nő.
Technológiai innovációk: Genetikailag módosított disznóktól a bioengineered graftokig
A bőr xenotranszplantáció – bőr átültetése nem emberi fajokból emberekbe – jelentős technológiai előrelépéseken ment keresztül 2025-re, sürgős klinikai igények, mint például a súlyos égési sérülések és krónikus sebek következtében. A terület gyorsan fejlődik, a genetikailag módosított sertésekre és a bioengineered graftokra összpontosít, amelyek célja az immunológiai akadályok legyőzése és a graft túlélés javítása.
A genetikailag módosított sertések a xenogén bőr elsődleges forrásaivá váltak, köszönhetően fiziológiai hasonlóságuknak az emberekkel és a sertés tenyésztés skálázhatóságának. Az olyan cégek, mint a Revivicor és az EGEBiotech, az élen járnak, olyan sertéseket fejlesztenek, amelyek több gén módosításon mentek keresztül, hogy csökkentsék a hyperacute elutasításért felelős antigének kifejeződését. Ezek a módosítások gyakran tartalmazzák a legfontosabb gének elrontását, melyek az alfa-gal kódolása mellett más xenointágenegek, valamint emberi komplement reguláló fehérjék beillesztését is célozzák, amelyek tovább csökkentik az immunválaszt.
2023-ban és 2024-ben a preklinikai vizsgálatok azt mutatták, hogy a genetikailag módosított sertésekből származó bőr graftok több hétig képesek voltak túlélni nem emberi primátusokban közvetlen elutasítás nélkül, ami jelentős előrelépés volt a korábbi próbálkozásokhoz képest. Az első szakaszos klinikai vizsgálatokra 2025-ben kerül sor, amelyeket a szabályozó ügynökségek szorosan figyelnek a biztonság és hatékonyság tekintetében. Az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága (FDA) iránymutatást adott a xenotranszplantációs protokollokra, és a cégek dolgoznak azon, hogy megfeleljenek ezeknek a szigorú követelményeknek.
A genetikai mérnökség előrehaladása mellett a bioengineered bőr graftok is teret nyernek. Ezek a graftok sertés eredetű extracelluláris mátrixokat kombinálnak emberi sejtekkel vagy szintetikus vázakkal, hogy hibrid strukturákat hozzanak létre, amelyek elősegítik az integrációt és a gyógyulást. Az Organogenesis és az AVITA Medical figyelemre méltó szereplők az ilyen termékek fejlesztésében, szakértelmüket a regeneratív medicinában és sebkezelésben kamatoztatva. Technológiájuk célja, hogy ideiglenes vagy tartós fedést biztosítson kiterjedt sebek számára, csökkentve a fertőzés kockázatát és javítva a betegek kimenetelét.
A jövőt illetően elmondható, hogy az elkövetkező években várhatóan megkezdődnek az első emberkísérletek a több génnel szerkesztett sertés bőr graftokkal, a biztonság, immunogenitás és funkcionális integráció fókuszálásával. A gene editing eszközökkel – mint a CRISPR/Cas9 – valószínűleg felgyorsítják még kompatibilisebb donor állatok kifejlesztését. Ezenkívül a 3D bioprinting és szövetmérnöki integrációja lehetővé teheti a graftok személyre szabását a páciens-specifikus igényekhez, tovább növelve a xenotranszplantációs technológiák klinikai hasznosságát.
Összességében a genetikai mérnökség, a szövetmérnökség és a szabályozási előrelépések konvergenciája a bőr xenotranszplantációt ígéretes megoldásnak tekinti kritikus, megoldásra váró orvosi szükségletekre, 2025 pedig meghatározó év lehet a klinikai átültetés és kereskedelmi értelemben.
Vezető cégek és kutatóintézetek: Profilok és stratégiai kezdeményezések
A bőr xenotranszplantáció – állati eredetű bőr graftok felhasználásával az emberi sebkezelésben – gyorsan fejlődött, számos cég és kutatóintézet áll az élen a preklinikai áttörések klinikai és kereskedelmi realitássá való fordításában. 2025-re a szektor egyesült biotechnológiai cégek, innovatív startupok és akadémiai együttműködések elegyét képviseli, amelyek célja az emberi donor bőr globális hiányának kezelése a súlyos égési sérülések és krónikus sebek tekintetében.
A xenotranszplantáció területének globális vezetője, a Revivicor (az United Therapeutics Corporation leányvállalata) kihasználta sertések genetikai mérnöki terén szerzett tapasztalatait, hogy csökkentett immunogenitású sertés szöveteket fejlesszen. Míg a Revivicor legjobban az éles szerv xenotranszplantáció helyén végzett munkájáról ismert, saját GalSafe sertéseik – amelyeket úgy terveztek, hogy hiányozzon belőlük az alpha-gal cukor, amely a hyperacute elutasítást okozza – szintén bőrgrafok forrásaként kerülnek vizsgálatra. A cég folyamatos együttműködései az akadémiai orvosi központokkal várhatóan korai fázisú klinikai adatokat szolgáltatnak a sertés bőrgraftok biztonságosságáról és hatékonyságáról a következő néhány évben.
Egy másik jelentős szereplő a Genopole, Franciaország vezető bioklasztere a genetikai és biotechnológiai innováció terén, amely támogat számos startupot és kutatócsoportot a xenotranszplantáció területén. Inkubátorával és finanszírozási programjaival a Genopole elősegíti a genetikailag módosított állatmodellek és fejlett szövetmérnöki platformok kifejlesztését, különös figyelmet szentelve az immunmodulációnak és a fertőzéskontrollnak a bőrgraftok terén.
Ázsiában a Sinogene Biotechnology kibővítette portfólióját az állatklónozásból a genetikailag módosított sertések fejlesztésére a biomedikai alkalmazásokhoz, beleértve a bőr xenograftokat is. A cég kutatási részlege aktívan együttműködik kínai kórházakkal a sertés bőr klinikai vizsgálatainak kezdeményezésében, a szabályozási benyújtásokra 2026-ra számítva.
Az akadémiai intézmények kulcsszerepet játszanak a terület előmozdításában. A Massachusetts General Hospital (MGH) Transzplantációs Központ a biotechnológiai cégekkel együttműködve preklinikai vizsgálatokat végez az immunoszuppresszív rendszerekről és génszerkesztett sertés bőrről. Az MGH kutatásának várhatóan szerepe lesz az Egyesült Államokban folyó első emberi vizsgálatok tervezésében, amelyek lehetőség szerint a következő két-három éven belül megkezdődnek.
A jövőt illetően a stratégiai kezdeményezések ezekben a szervezetekben a genetikai módosítások finomítására, a kórokozók mentes állattartás skálázására és a fejlődő szabályozási keretek navigálására összpontosítanak. A következő évek várhatóan az első kontrollált klinikai vizsgálatokat hozzák a génnel módosított sertés bőrrel, a világégés kezelésében és sebkezelésben meghatározó áttörések lehetőségével.
Klinikai kísérletek és valós alkalmazások: Haladások és eredmények
A bőr xenotranszplantáció – bőr átültetése nem emberi fajokból, elsősorban genetikailag módosított sertésekből emberekbe – az utóbbi években gyorsan fejlődött, 2025 pedig meghatározó periódus lesz a klinikai átültetés és a valós alkalmazás terén. A technológia a súlyos égési sérültek és a kiterjedt bőrkiesésben szenvedő páciensek számára kritikus hiányosságok kezelésére irányul, ígéretes megoldást kínálva ott, ahol az emberi donor bőr nem áll rendelkezésre.
2024 és 2025 folyamán több korai fázisú klinikai kísérlet kezdődött el vagy folyik, a sertés eredetű bőrgraftok biztonságosságára, immunogenitására és hatékonyságára összpontosítva. Különösen a Xenothera, egy francia biotechnológiai cég, a főszereplők között van, aki szakértelmét kihasználva immunmodulációs és genetikai mérnöki megoldásokat fejleszt, csökkentett immunogenitású sertés bőrgraftokkal. Preklinikai tanulmányaik ígéretes eredményeket mutattak a heveny elutasítás minimálisra csökkentésében, és 2025-ben a cég várhatóan kedvező adatokat fog közölni első emberi vizsgálataiból.
Egy másik kulcsszereplő, a Revivicor (az United Therapeutics leányvállalata), több génnel módosított sertéseket fejlesztett ki, melyek szövetei az emberi immunrendszerrel való kompatibilitásra lettek tervezve. 2024-ben a Revivicor sertés bőrgraftjai belekerültek a kivételes használati protokollokba néhány amerikai égési központban, ahol a korai eredmények javuló graft túlélést és csökkent immunoszuppressziós szükségletet jeleztek a korábbi generációs xenograftokhoz képest. A cég a kiváló orvosi központokkal együttműködve 2025-re várhatóan hivatalos I/II. fázisú kísérleteket indít, a súlyos égéskezelésre és a krónikus sebkezelésre összpontosítva.
Ázsiában a Sinogene, egy kínai biotechnológiai cég, bejelentette genetikailag módosított sertések kifejlesztését xenotranszplantációra. 2025-ben a Sinogene várhatóan pilot klinikai vizsgálatokat indít, együttműködve a jelentős kínai kórházakkal, célul kitűzve a súlyos égési sérülések magas előfordulását a térségben.
A valós alkalmazások továbbra is korlátozódnak a szigorúan szabályozott klinikai környezetekre, a nemzeti egészségügyi hatóságok szigorú felügyelete alatt. Az együttérzés keretei és kiterjesztett hozzáférési programjaik korai adatainál azt mutatják, hogy a genetikailag módosított sertés bőrgraftok hatékony ideiglenes sebelfedést biztosíthatnak, csökkenthetik a fertőzések arányát, és elősegíthetik a gyógyulást addig, amíg az autológ graftok lehetségesek. Ugyanakkor a hosszú távú eredmények, beleértve a krónikus elutasítást és zoonózisos kockázatokat, még szoros nyomon követést igényelnek.
A jövőt nézve elmondható, hogy az elkövetkező évek során várhatóan bővülnek a klinikai kísérletek, finomodik a genetikai módosításokkal a további immunogenitáscsökkentés érdekében, valamint a xenograft alkalmazására szabványosított protokollok kifejlesztése. Az Egyesült Államokban, Európában és Ázsiában a szabályozó ügynökségek szorosan figyelnek ezekre a fejleményekre, potenciálisan feltételezett engedélyekkel, ha a folytatódó vizsgálatok továbbra is biztosítják a biztonságosságot és hatékonyságot. A terület jelentős áttörések előtt áll, és ígéretes, hogy globálisan megváltoztatja az égés- és sebkezelést.
Szabályozási környezet: Engedélyek, irányelvek és globális eltérések
A bőr xenotranszplantációs technológiák szabályozási környezete gyorsan fejlődik, ahogy a tudományos előrelépések közelebb viszik ezeket a termékeket a klinikai alkalmazáshoz. 2025-re a világ különböző régióinak szabályozó ügynökségei aktívan dolgoznak a keretek kidolgozásán és finomításán, amelyek kezelik a xenogén bőrgraftokkal kapcsolatos egyedi kihívásokat, különösen a genetikailag módosított sertésekből származó anyagokat. Ezek a kihívások közé tartozik a zoonózis átadásával, immunológiai kompatibilitással, etikai megfontolásokkal és hosszú távú biztonsági ellenőrzésekkel kapcsolatos aggályok.
Az Egyesült Államokban az Élelmiszer- és Gyógyszerügyi Hivatal (FDA) irányelveket állapított meg a xenotranszplantációs termékek számára, amelyek szigorú preklinikai és klinikai adatokat követelnek meg a biztonság és hatékonyság igazolására. Az FDA Biológiai Értékelési és Kutatási Központja (CBER) felügyeli a termékek szabályozási folyamatát, hangsúlyozva a széleskörű kockázatelemzéseket, beleértve a sertés endogén retrovírus (PERV) átvitelének lehetőségét. Az utóbbi években az FDA engedélyezett Kísérleti Új Gyógyszer (IND) jóváhagyásokat a genetikailag módosított sertéshús graftok korai fázisú klinikai vizsgálatainak, ami óvatos, de előremutató hozzáállásról tanúskodik.
Európában az Európai Gyógyszerügynökség (EMA) a Xenotranszplantációs termékek szabályozása az Advanced Therapy Medicinal Products (ATMP) keretén belül történik. Az EMA széleskörű dokumentációt igényel a donor állatok egészségi állapotáról, genetikai változtatásairól és gyártási folyamatairól. Az ügynökség a tagállamok közötti harmonizált felügyelet biztosítása érdekében is koordinál a nemzeti hatóságokkal. Határozottan kiemelendő, hogy az EMA tudományos tanácsokat adott több cégnek, akik sertésbőr graftokat fejlesztenek, jelezve a növekvő szabályozói elköteleződést a területen.
Az ázsiai-csendes-óceáni országok, különösen Japán és Dél-Korea, szintén előrehaladnak a xenotranszplantációs szabályozási keretek fejlesztésében. Japán Gyógyszerek és Orvosi Eszközök Ügynöksége (PMDA) iránymutatásokat tett közzé a xenogén szövetek klinikai felhasználására, a fertőzések ellenőrzésére és az átültetés utáni nyomon követésre összpontosítva. Dél-Korea Élelmiszer- és Gyógyszerbiztonsági Minisztériuma (MFDS) szintén frissíti szabályozásait, hogy alkalmazkodjon a fejlődő xenotranszplantációs technológiákhoz.
Globálisan jelentős eltérések vannak a szabályozási követelményekben; egyes országok kedvezőbb megközelítéseket alkalmaznak a klinikai vizsgálatokhoz, míg mások szigorú tilalmakat tartanak fenn a xenotranszplantációval kapcsolatban. A Nemzetközi Tanács a Gyógyszerek Emberi Felhasználására vonatkozó Technikai Követelmények Harmonizációjára (ICH) olyan kezdeményezéseket folytat, amelyek a szabványok harmonizálására irányulnak, de lényeges eltérések továbbra is fennállnak.
A jövőt nézve elmondható, hogy az elkövetkező években várhatóan növekszik a szabályozói tisztaság, ahogy egyre több klinikai adat válik elérhetővé, és olyan cégek, mint a Revivicor és az eGenesis, előrelépnek a genetikailag módosított sertésbőr graft programjaikban. A szabályozó ügynökségek valószínűleg frissítik irányelveiket az új tudományos ismeretek tükrében, a betegek biztonságára, nyomon követésére és hosszú távú ellenőrzésére helyezve a középpontot. A fejlődő tájéknak szoros együttműködést igényel az ipar, a szabályozók és a tudományos közösség között, hogy a bőr xenotranszplantációs technológiák megfelelő és hatékony átfordítása biztosított legyen a klinikai gyakorlatba.
Etikai, biztonsági és immunológiai megfontolások a xenotranszplantációban
A bőr xenotranszplantáció – bőr átültetése nem emberi fajokból, elsősorban genetikailag módosított sertésekből emberekbe – az utóbbi években gyorsan fejlődött, de jelentős etikai, biztonsági és immunológiai ellenőrzés alatt áll. 2025-re a terület az előklinikai tanulmányokból a korai szakaszú klinikai alkalmazások felé halad, olyan kihívások kezelése érdekében, amelyek a keresztspeciesű transzplantációval járnak.
A fő etikai aggály a genetikailag módosított állatok használata körül forog. Az olyan cégek, mint a Revivicor és az eGenesis az élen járnak, olyan sertéseket fejlesztenek, amelyek több génmódosításon estek át, hogy csökkentsék az immunogenitást és a zoonózis kockázatát. Ezek a módosítások, bár ígéretesek az elutasítás csökkentésére, kérdéseket vetnek fel az állatjólétről, a hosszú távú ökológiai hatásokról és arról, hogy mennyire elfogadható az állati szervek és szövetek felhasználása az emberek javára. Az Egyesült Államok, az EU és Ázsia szabályozó testületei aktívan dolgoznak a keretek létrehozásán, amelyek kezelik ezeket a kérdéseket, hangsúlyozva a transzparenciát, az állatjóléti normákat és a közérdeklődést.
A biztonság továbbra is kulcsfontosságú kérdés, különös figyelmet fordítva a sertés endogén retrovírusok (PERV) és más kórokozók átvitelének kockázatára. A Revivicor és az eGenesis egyaránt fejlett génszerkesztési technológiákat, például a CRISPR-t alkalmaznak, hogy inaktiválják a PERV szekvenciákat a donor sertésekben. Az 2025 eleji preklinikai és együttérző használati esetekből származó adatok azt mutatják, hogy ezek az intézkedések jelentősen csökkentik, de nem teljesen szüntetik meg a zoonózis kockázatát. Folyamatos ellenőrzések és szigorú szűrési protokollok kerülnek bevezetésre minden klinikai protokollban, a nemzeti egészségügyi hatóságok és olyan szervezetek felügyelete alatt, mint az International Xenotransplantation Association.
Az immunológiai elutasítás továbbra is a legnagyobb technikai akadályt jelenti. Az emberi immunrendszer gyors és robusztus választ indít a xenogén szövetek ellen, ami hyperacute és késleltetett elutasításhoz vezet. E problémák kezelésére a cégek olyan sertéseket fejlesztenek, amelyek nem tartalmaznak kulcsfontosságú antigéneket (például alfa-gal), és kifejezik az emberi komplement reguláló fehérjéket. 2024 és 2025 során több korai fázisú klinikai vizsgálat és együttérző használati esetek bemutatták a sertés bőrgraftok ideiglenes beültetését égési betegek esetén, amelyek kritikus sebfedést biztosítanak, miközben autológ graftok várakoznak. Ennek ellenére a xenograftok hosszú távú fennmaradása még mindig elérhetetlen, és az immunoszuppressziós rendszerek önmagukban is kockázatokat hordoznak.
A jövőt nézve elmondható, hogy az elkövetkező évek várhatóan a klinikai vizsgálatok bővülését, a donorállatok genetikai mérnökségének javulását és egyre célzottabb immunmoduláló terápiák kifejlesztését hozzák. A terület emellett az etikai és biztonsági normák nemzetközi harmonizálásához is közelít, az olyan ipari vezetők, mint a Revivicor és az eGenesis együttműködnek a szabályozó ügynökségekkel és bioetikai bizottságokkal, hogy biztosítsák a felelősségteljes előrehaladást. A bőr xenotranszplantáció kilátása óvatosan optimista, a remény, hogy a súlyos égési sérülésekhez szükséges bőr graftok kritikus hiányosságait kezelheti, feltéve, hogy etikai, biztonsági és immunológiai kihívásokat folyamatosan szigorúan kezelik.
Ellátási lánc, gyártási és skálázhatósági kihívások
A bőr xenotranszplantációs technológiák, amelyek nem emberi forrásokból (főként genetikailag módosított sertésekből) származó bőr átültetését foglalják magukban emberekben, 2025-re gyorsan fejlődnek. A szektor azonban jelentős ellátási lánc, gyártási és skálázhatósági kihívásokkal néz szembe, miközben az empirikus és együttérző használati esetekből szélesebb körű klinikai alkalmazás felé tart.
Az egyik fő kihívás a donor állatok megbízható és etikus beszerzése. Az olyan cégek, mint a Revivicor (az United Therapeutics leányvállalata), olyan genetikailag módosított sertéseket fejlesztenek, amelyek célja az immunválasz és zoonózis kockázatának minimalizálása. Ezek a sertések szigorúan ellenőrzött tenyésztési, lakhatási és figyelési környezetet igényelnek a biosecurity és a genetikai következetesség biztosítása érdekében, ami növeli a működési összetettséget és a költségeket. A tenyészetek növelése a potenciális klinikai igények kielégítése érdekében, a szigorú normák fenntartása mellett, továbbra is szűk keresztmetszetet jelent.
A xenogén bőr graftok gyártása összetett bioprocesszálási lépéseket foglal magában, beleértve az aratást, dekondicionálást (amennyiben acelluláris mátrixokat használnak), sterilizálást és tartósítást. Minden lépésnek meg kell felelnie a szigorú szabályozási követelményeknek a Jó Gyártási Gyakorlat (GMP) szempontjából. A Revivicor és más újonnan megjelenő szereplők befektetnek a dedikált biogyártási létesítményekbe, de a működésük skálázásához szükséges tőke és szakértelem jelentős. A specializált tiszta szobák és az érvényesített hideg lánc logisztika iránti igény tovább bonyolítja az ellátási láncot.
Egy másik kihívás az állatlétesítmények, feldolgozó üzemek és klinikai helyszínek közötti koordináció. Az élő szövet termékek időérzékeny természetének biztosítása robusztus logisztikát és valós idejű nyomon követést igényel. A cégek olyan partnerségeket keresnek, amelyek beinvitálják a megalapozott biogyógyszeripari logisztikai szolgáltatókat, hogy a termékek időben és biztonságosan érkezzenek, de a xenogén szövetek nagy volumenű, határokon átívelő forgalmazásának infrastruktúrája továbbra is kezdetleges.
A szabályozó felügyelet egy újabb bonyolítási szintet ad. Olyan ügynökségek, mint az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatal (FDA), átfogó nyomon követhetőséget követelnek meg a donor állattól a betegig, beleértve a genetikai módosítások, egészségi állapot és feldolgozási lépések dokumentációját. Ez fejlett digitális nyomon követési rendszereket és átlátható ellátási lánc menedzsmentet igényel, amelyet sok cég még fejleszt.
A jövőt nézve a szektor várhatóan fokozatos javulásokat fog átélni a skálázhatóság terén, ahogy az automatizáció, digitalizáció és ellátási lánc integráció érik. Az olyan cégek, mint az United Therapeutics (a Revivicor szülővállalata) vertikálisan integrált modellekbe fektetnek be, hogy ellenőrizzék az egész folyamatot az állattartástól a klinikai ellátásig. Azonban a széleskörű elfogadás a jelenlegi bottleneckek leküzdésétől függ az állatitermelői ellátás, bioprocesszing kapacitás és szabályozási harmonizáción keresztül a különböző régiókban. A következő néhány év kulcsszerepet játszik a robusztus, skálázható ellátási láncok létrehozásában, amelyek támogathatják a bőr xenotranszplantációjának átállását az empirikus terápiából a rutinszerű klinikai gyakorlatba.
Versenyhelyzet: Allograftok, autograftok és szintetikus alternatívák
A bőr xenotranszplantációs technológiák versenyképes tája 2025-re gyorsan fejlődik, a súlyos égési sérülések, krónikus sebek és rekonstrukciós sebészet hatékony bőrpótlásainak sürgős szükséglete által irányítva. A hagyományos megközelítések – autograftok (a beteg saját bőre) és allograftok (donor emberi bőr) – továbbra is a klinikai arany standardok, de mindkettő jelentős korlátokkal néz szembe. Az autograftok korlátozottak a donorhely morbiditása és a széleskörű sérülések esetén rendelkezésre álló bőrmennyiség miatt, míg az allograftok immunológiai elutasítás és betegség átadásának kockázatát hordozzák, és gyakran hiányosak a kereslethez képest.
A xenotranszplantáció területén az innovációk fokozódnak, különösen sertés (disznó származású) bőr révén, amely fiziológiai hasonlóságának köszönhetően az emberi bőrhöz és a skalázható ellátáshoz kínál alternatívát. Az olyan cégek, mint a Revivicor, az United Therapeutics leányvállalata, az élen járnak, kihasználva a fejlett genetikai mérnökséget, hogy kevesebb immunogenitású sertéseket állítsanak elő. Munkájuk az érintett áttörést xenotranszplantációs szervi területen végzett sikerességén alapul, ahol a genetikailag módosított sertések a hyperacute elutasítás és más immunválaszok minimalizálására lettek tervezve. 2024-ben a Revivicor sertés bőrgraftjai kiválósági klinikai vizsgálati fázisban kezdtek megjelenni a kiválasztott égési központokban, az első eredmények pedig a graftok túlélésének és a gyulladásos komplikációk csökkenésének förbősítéséről számoltak be a hagyományos xenograftokhoz képest.
Egy másik figyelemre méltó szereplő a Genesis Biosciences, amely decellularizált sertés bőr mátrixokat fejleszt. Ezek a termékek biokompatibilis vázat céloznak meg, amely elősegíti a gazda sejtek infiltrálódását és vaskulárizációját, miközben minimalizálja a zoonózis átadásának kockázatát. A Genesis Biosciences együttműködik a szabályozó ügynökségekkel az Egyesült Államokban és Európában, hogy előmozdítsák ezeket a termékeket klinikai vizsgálatokon keresztül, kulcsfontosságú adatokkal 2025 végére várhatók.
Közben a szintetikus és bioszintetikus bőrpótlók továbbra is versenyeznek a piacon, megalapozott cégekkel, mint például a Smith & Nephew és az Organogenesis, amelyek olyan termékeket kínálnak, mint az Integra® és Dermagraft®. Ezek az alternatívák a polcokon való rendelkezésre állást biztosítják és kiküszöbölik az állati vagy humán betegségátadási kockázatokat, de gyakran hiányzik belőlük a teljes biológiai funkcionalitás, és kevésbé hatékonyak a nagy vagy összetett sebek esetében.
A jövőt nézve a következő néhány évben várhatóan a xenotranszplantáció és a fejlett szövetmérnökség közötti fokozott összefonódás valósul meg. A cégek olyan lehetőségeket keresnek, hogy integrálják a génnel módosított sertés sejteket bioaktív vázakkal és 3D bioprinting technológiákkal következő generációs bőrpótlók kialakításához. A szabályozási utak is fejlődnek, az FDA és EMA ügynökségek új utakat biztosítanak a xenogén termékekhez, ami potenciálisan felgyorsíthatja a biztonságos és hatékony megoldások piacra jutását. Ahogy a klinikai adatok felhalmozódnak és a gyártás bővül, a bőr xenotranszplantációs technológiák átalakító választásokká válhatnak a sebkezelés és rekonstrukciós medicina versenyhelyzetében.
Jövőbeli kilátások: Zavaró tendenciák, befektetési középpontok és hosszú távú hatás
A bőr xenotranszplantáció – bőr nem emberi fajtáihoz tartozó átültetése emberekbe – 2025-ben elképzelhetően kulcsfontosságú helyzet elé néz, amivel a genetikai mérnökség, immunmoduláció és biogyártás területein elért előrelépések vezérlik. A terület elsősorban arra összpontosít, hogy kezelje a súlyos égési sérültek és a krónikus sebekkel küzdő betegek bőr donorjának kritikus hiányosságát. Az utóbbi években megnövekedett befektetési és kutatási hullám, ahol számos cég és kutatási konzorcium túllépi a lehetőségek határait.
Az egyik jelentős zavaró tendencia a genetikailag módosított porcine (disznó) bőr használata, amely célja az immunogenitás és a zoonózisos betegségátadás kockázatának csökkentése. Az olyan cégek, mint a Revivicor, az United Therapeutics leányvállalata, úttörő szerepet játszottak a több génszerkesztett sertések kifejlesztésében, amelyek szövetei kevésbé valószínű, hogy elutasításra kerülnek az emberi immunrendszer által. 2023-ban és 2024-ben az előklinikai és korai klinikai vizsgálatok azt mutatták, hogy a disznóból készült bőrgraftok hetekig képesek voltak túlélni emberi fogadókon közvetlen elutasítás nélkül, ami jelentős előrelépés az előző próbálkozásokhoz képest. Ezek az előrelépések a CRISPR és más génszerkesztési technológiákra épülnek, amelyek lehetővé teszik az antigének precíz eltávolítását és emberi-kompatibilis gének beillesztését.
Egy másik kulcsszereplő, az eGenesis fejlett génszerkesztési megoldásokat kihasználva több mint 60 genetikai módosítást hoz létre a sertések esetében, amelyek célja az immunológiai kompatibilitás javítása és a sertés endogén retrovírusok (PERVs) eltávolítása. Munkája szoros figyelemmel kísérve követi a szabályozó ügynökségeket és a szélesebb transzplantációs közösséget, mivel az az első emberi xenogén bőr próbák színpadának felállításához vezet.
Befektetési középpontok fejlődnek Észak-Amerikában, Európában és Kelet-Ázsiában, a nyilvános és magánfinanszírozás fokozott áramlásával a mind established biotechnológiai cégekbe, mind az akadémiai-ipari partnerségekbe. Az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) és az Európai Gyógyszerügynökség (EMA) nyitott státusza jelezi, hogy felgyorsított utakon keresztül dolgoznak a xenotranszplantációs termékekhez, ha megfelelően bemutatásra kerülnek a biztonságossági és hatékonysági adatok. Ez a szabályozási rugalmasság arra számít, hogy elősegíti a további befektetéseket és a klinikai átültetést.
Nézve az elkövetkező éveket, az első engedélyezett klinikai vizsgálatok várhatóan gene editált sertés bőr ideiglenes sebfedésére irányulnak, különösen azokban az esetekben, amikor az emberi allograftok nem állnak rendelkezésre. Ha a vizsgálatok sikeresek, ezek a termékek forradalmasíthatják a jelenlegi kezelési standardot, csökkentve a halálozást és morbiditást az égési sérültek körében világszerte. Hosszú távon a xenotranszplantáció integrálása a szövetmérnökséggel – például a sertés vázak és emberi őssejtek kombinálásával – még fejlettebb bőrpótlókat eredményezhet.
Ezeknek a technológiáknak a hatása túllép a klinikai eredményeken. Ígéretet tesznek arra, hogy alakítják az ellátási láncokat, csökkentik az egészségügyi költségeket és új piacokat nyitnak a biogyártott szövetek számára. Ahogy az etikai, szabályozási és technikai kihívásokat kezelik, a bőr xenotranszplantáció ígéretesen a regeneratív medicina alapvető részévé válhat a következő évtized végére.
Források és hivatkozások
- Revivicor
- United Therapeutics
- Xenothera
- eGenesis
- Organogenesis
- AVITA Medical
- Genopole
- European Medicines Agency
- International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use
- Genesis Biosciences
- Smith & Nephew